NS ความสามารถในการละลายสามารถกำหนดเป็น ปริมาณตัวถูกละลายสูงสุดที่สามารถละลายได้ในตัวทำละลายจำนวนหนึ่งที่อุณหภูมิที่กำหนด
ปริมาณสูงสุดที่สามารถละลายได้นี้เรียกอีกอย่างว่า ค่าสัมประสิทธิ์การละลาย หรือ ระดับการละลาย. แต่ความสามารถในการละลายของสารใด ๆ ขึ้นอยู่กับชนิดของตัวทำละลายที่ตัวถูกละลายกระจายตัว
ตัวอย่างเช่น NaCl (โซเดียมคลอไรด์ - เกลือแกง) ละลายได้ดีในน้ำ และในน้ำ 1 ลิตรที่อุณหภูมิ 20ºC เราสามารถละลายเกลือนี้ได้มากถึง 360 กรัม แต่เมื่อตัวทำละลายเปลี่ยนเป็นน้ำมันเบนซิน ภายใต้สภาวะปริมาตร อุณหภูมิ และความดันเดียวกัน เกลือจะไม่ละลาย
เหตุใดความสามารถในการละลายของสารจึงแตกต่างกันมากจากตัวทำละลายตัวหนึ่งไปอีกตัวหนึ่ง?
ปัจจัยหนึ่งคือ ขั้ว ของสารประกอบที่เกี่ยวข้อง ในตัวอย่างที่อ้างถึง เรามีว่า เกลือมีขั้ว น้ำมีขั้ว และน้ำมันเบนซินไม่มีขั้ว เกลือเกิดจากอะตอมของโซเดียม (Na) และคลอรีน (Cl) ที่พันธะผ่านพันธะไอออนิก ซึ่งโซเดียมจะบริจาคอิเล็กตรอนให้กับคลอรีน ทำให้เกิด Na ion+ และ Cl-. เนื่องจากไอออนเหล่านี้มีประจุตรงข้ามกัน พวกมันจึงดึงดูดและจับกัน (Na+Cl-).

นี่แสดงให้เราเห็นว่าเกลือมีขั้วจริงๆ พันธะไอออนิกทุกตัวมีขั้ว เนื่องจากประจุไฟฟ้าในสารประกอบมีความแตกต่างกัน
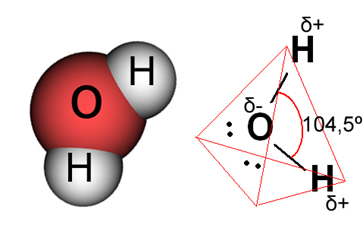
ในกรณีของน้ำ พันธะที่มีอยู่คือโควาเลนต์ ซึ่งไฮโดรเจนสองอะตอมใช้อิเล็กตรอนร่วมกับอะตอมออกซิเจน โมเลกุลของน้ำมีไดโพลสองขั้ว โดยที่ออกซิเจนมีประจุลบบางส่วน และไฮโดรเจนมีประจุบวกบางส่วน (δ- โอ ─ เอช δ+). แต่ไดโพลเหล่านี้ไม่หักล้างกันเนื่องจากโมเลกุลของน้ำมาบรรจบกันที่มุม 104.5º แสดงว่าการกระจายและประจุตามโมเลกุลไม่สม่ำเสมอ มีความหนาแน่นประจุลบมากขึ้นในอะตอมออกซิเจนของโมเลกุล นี่แสดงให้เราเห็นว่าโมเลกุลของน้ำนั้นมีขั้วจริงๆ
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
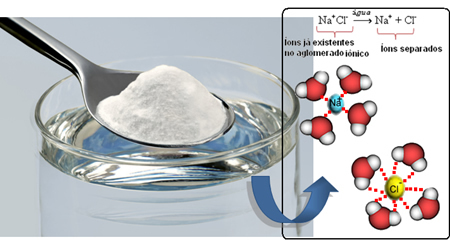
ดังนั้นเมื่อเราผสมเกลือลงไปในน้ำ ส่วนที่เป็นบวกของเกลือ ซึ่งก็คือ Na cations+ถูกดึงดูดโดยส่วนลบของน้ำ คือ ออกซิเจน และส่วนที่เป็นลบของเกลือ (Cl anions-) ถูกดึงดูดโดยส่วนบวกของน้ำ (H+). ดังนั้น สหภาพนา+Cl- มันแตกออกทำให้เกลือละลายในน้ำ
ในทางกลับกัน น้ำมันเบนซินเกิดจากส่วนผสมของไฮโดรคาร์บอนต่างๆ ซึ่งไม่มีขั้ว นั่นคือ การกระจายประจุไฟฟ้าของน้ำมันเบนซินจะสม่ำเสมอ ดังนั้นจึงไม่มีปฏิกิริยาระหว่างเกลือไอออนกับน้ำมันเบนซินและไม่ละลาย
กรณีเหล่านี้และกรณีอื่นๆ ที่คล้ายคลึงกันทำให้เราได้ข้อสรุปดังต่อไปนี้:

อย่างไรก็ตาม สิ่งนี้ไม่ถือเป็นกฎทั่วไป เนื่องจากมีหลายกรณีที่ตัวถูกละลายที่ไม่มีขั้วซึ่งละลายได้ดีในตัวทำละลายที่มีขั้วและในทางกลับกัน ดังนั้น เพื่อให้เข้าใจว่าเหตุใดจึงเกิดขึ้น เราต้องพิจารณาปัจจัยอื่น: ประเภทของ แรงระหว่างโมเลกุล ของตัวทำละลายและตัวถูกละลาย
กฎหมายเกี่ยวกับเรื่องนี้ในข้อความ: "ความสัมพันธ์ระหว่างความแข็งแรงระหว่างโมเลกุลกับการละลายของสาร”.
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
โฟกาซ่า, เจนนิเฟอร์ โรชา วาร์กัส "ความสัมพันธ์ระหว่างขั้วกับการละลายของสาร"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/relacao-entre-polaridade-solubilidade-das-substancias.htm. เข้าถึงเมื่อ 27 กรกฎาคม 2021.



