ปฏิกิริยาออกซิเดชัน-รีดิวซ์ที่เกิดขึ้นต่อหน้าไฮโดรเจนเปอร์ออกไซด์ (สารละลายไฮโดรเจนเปอร์ออกไซด์ในน้ำ - H2โอ2(aq)) เป็นกรณีพิเศษที่ต้องวิเคราะห์แยกกัน ส่วนใหญ่เกี่ยวกับความสมดุล เนื่องจากออกซิเจนในไฮโดรเจนเปอร์ออกไซด์ซึ่งมี Nox เท่ากับ -1 สามารถออกซิไดซ์หรือลดลงได้
ตัวอย่างเช่น ลองดูสองกรณีที่มันทำหน้าที่เป็นตัวออกซิไดซ์ (รีดิวซ์) ก่อน แล้วจึงทำหน้าที่เป็นตัวรีดิวซ์ (ออกซิไดซ์):
- ออกซิไดซ์: เมื่อใดก็ตามที่ไฮโดรเจนเปอร์ออกไซด์ลดลง ซึ่งทำหน้าที่เป็นตัวออกซิไดซ์ ก็จะผลิตน้ำออกมาเป็นผลิตภัณฑ์
หากเราเติมสารละลายไฮโดรเจนเปอร์ออกไซด์ลงในสารละลายที่มีไอออนไอโอไดด์ (I-) ในตัวกลางที่เป็นกรด เราจะมี:
โฮ2โอ2(aq) + ฉัน-(ที่นี่) +โฮ+(ที่นี่) → ฮ2โอ(1) + ฉัน2(s)
เห็นว่าน้ำและไอโอดีนก่อตัวขึ้น แต่หากต้องการตรวจสอบว่าไฮโดรเจนเปอร์ออกไซด์ทำหน้าที่เป็นตัวออกซิไดซ์จริงหรือไม่และลดลง ให้สังเกตการกำหนดหมายเลขออกซิเดชัน (NOx):*

ออกซิเจน Nox ของไฮโดรเจนเปอร์ออกไซด์ลดลงจาก -1 เป็น -2 เนื่องจากได้รับอิเล็กตรอน 1 ตัว อย่างไรก็ตาม เนื่องจากเรามีออกซิเจน 2 ตัวในแต่ละโมเลกุลของไฮโดรเจนเปอร์ออกไซด์ (H2โอ2) รูปแบบ Nox จะเท่ากับ 2
ดังที่แสดงในข้อความว่า “สมดุลรีดอกซ์” ขั้นตอนที่จำเป็นในการสร้างสมดุลของปฏิกิริยาโดยวิธีรีดอกซ์คือการกลับค่าของการแปรผันของ Nox ด้วยค่าสัมประสิทธิ์ ในกรณีนี้ ดังต่อไปนี้:
* โฮ2โอ2 = 2 (∆Nox) = 2 → 2 จะเป็นสัมประสิทธิ์ของ I-;
* ผม-= ∆Nox = 1 → 1 จะเป็นสัมประสิทธิ์ของ H2โอ2.
ดังนั้นเราจึงมี:
1 ชั่วโมง2โอ2(aq) + 2 ฉัน-(ที่นี่) + โฮ+(ที่นี่) → ฮ2โอ(1) + ฉัน2(s)
ตีค่าสัมประสิทธิ์อื่น ๆ โดยการปรับสมดุลโดยการทดลอง:
- เนื่องจากมีออกซิเจนสองอะตอมในสมาชิกที่ 1 สัมประสิทธิ์ของน้ำในสมาชิกที่ 2 ต้องเท่ากับ 2 และเนื่องจากมีไอออนไอโอไดด์สองตัวในสมาชิกที่ 1 ค่าสัมประสิทธิ์ไอโอดีนในสมาชิกที่ 2 จะเป็น 1 อย่าลืมว่าเราต้องคูณดัชนีด้วยสัมประสิทธิ์เพื่อหาจำนวนอะตอมและไอออนที่ถูกต้องในสมาชิกแต่ละตัว:
1 ชั่วโมง2โอ2(aq) + 2 ฉัน-(ที่นี่) +โฮ+(ที่นี่) → 2 ชั่วโมง2โอ(1) +1 ฉัน2(s)
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
- ตอนนี้เหลือเพียงการปรับสมดุลไฮโดรเจนไอออนบวกของสมาชิกที่ 1 และสัมประสิทธิ์จะต้องเท่ากับ 2 เพราะในสมาชิกที่ 2 มี 4 ไฮโดรเจน และในสมาชิกที่ 1 มีอยู่แล้วสอง:
1 ชั่วโมง2โอ2(aq) + 2 ฉัน-(ที่นี่) +2 ฮ+(ที่นี่) → 2 ชั่วโมง2โอ(1) +1 ฉัน2(s)
- ตัวรีดิวซ์: เมื่อใดก็ตามที่ไฮโดรเจนเปอร์ออกไซด์ออกซิไดซ์ทำหน้าที่เป็นตัวรีดิวซ์ มันจะสร้างออกซิเจน (O2) เป็นผลิตภัณฑ์
ตัวอย่างที่ไฮโดรเจนเปอร์ออกไซด์กำลังลดลงคือเมื่อสัมผัสกับโพแทสเซียมเปอร์แมงกาเนต (KMnOKM4). สารนี้มีสีม่วงที่มีลักษณะเฉพาะ แต่เมื่อสัมผัสกับไฮโดรเจนเปอร์ออกไซด์ สารนี้จะกลายเป็นไม่มีสี เนื่องจากแมงกานีสทั้งหมดมีอยู่ใน MnO ion4- ของสารละลายเปอร์แมงกาเนตลดลง ทำให้เกิด Mn ion2+ดังที่แสดงด้านล่าง:
+1 -1 +7 -2 +1 0 +2 +1 -2
โฮ2โอ2 + MnO4-+ โฮ+ → ดิ2 + มิน2++ โฮ2โอ
เมื่อคำนวณ Nox เราจะเห็นว่าออกซิเจนในไฮโดรเจนเปอร์ออกไซด์ออกซิไดซ์และทำให้แมงกานีสลดลง:
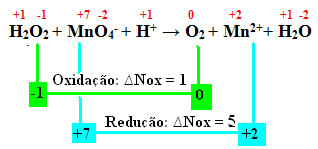
ดังในตัวอย่างก่อนหน้านี้ ∆Nox ของไฮโดรเจนเปอร์ออกไซด์จะเท่ากับ 2 เนื่องจากมีออกซิเจน 2 ตัวและแต่ละตัวสูญเสียอิเล็กตรอนไปหนึ่งตัว ดังนั้นเราจึงมี:
* O2 = 2 (∆Nox) = 2 → 2 จะเป็นสัมประสิทธิ์ของ MnO4-;
*MnO4- = ∆Nox = 5 → 5 จะเป็นค่าสัมประสิทธิ์ของO2.
และชอบ O. ทั้งหมด2 มาจากไฮโดรเจนเปอร์ออกไซด์ สารทั้งสองมีค่าสัมประสิทธิ์เท่ากัน:
5 โฮ2โอ2 + 2MnO4-+ โฮ+ → 5 โอ2 + มิน2++ โฮ2โอ
สมดุลโดยวิธีทดลอง เรามี:
5 ชั่วโมง2โอ2 + 2 นาที4-+ 6 ชั่วโมง+ → 5 ออนซ์2 + 2 นาที2++ 8 ชั่วโมง2โอ
* สำหรับคำถามเกี่ยวกับวิธีการคำนวณเลขออกซิเดชัน (Nox) ของอะตอมและไอออนในปฏิกิริยา โปรดอ่านข้อความ "การกำหนดหมายเลขออกซิเดชัน (NOx)"
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
โฟกาซ่า, เจนนิเฟอร์ โรชา วาร์กัส "ปฏิกิริยาการลดออกซิเดชันที่เกี่ยวข้องกับไฮโดรเจนเปอร์ออกไซด์"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-envolvendo-agua-oxigenada.htm. เข้าถึงเมื่อ 28 มิถุนายน 2021.