Научете се да прилагате първия закон на термодинамиката в различни ситуации, решавайте упражнения и проверявайте знанията си с решени и обяснени упражнения.
Въпрос 1
Първият закон на термодинамиката гласи, че:
а) Енергията не може да бъде създадена или унищожена, но може да се преобразува от една форма в друга.
б) Енергията винаги се запазва, но не може да се преобразува от една форма в друга.
в) Енергията може да бъде създадена или унищожена, но не може да бъде преобразувана от една форма в друга.
г) Енергията не може да се запази, но може да се преобразува от една форма в друга.
Първият закон на термодинамиката е принципът за запазване на енергията, така че в една система затворен, количеството енергия остава постоянно и може само да се трансформира от една форма в друга. друго.
въпрос 2
Да приемем затворена система, която получава 100 J топлина, докато извършва 50 J работа. Каква е промяната във вътрешната енергия на системата?
а) -50 Дж
б) 0 J
в) 50 Дж
г) 100 J
д) 150 J
Проверка на знаците:
Получената топлина е положителна Q > 0.
Извършената работа е положителна W > 0.
Според първия закон имаме:
въпрос 3
Една идеална газова система обменя 500 джаула топлина с външната среда. Ако приемем, че този процес е изометрично охлаждане, определете съответно работата и вътрешната енергия.
а) 500 J и 0 J
б) - 500 и 0 J
в) 0 J и 500 J
г) 0 J и - 500 J
д) -500 J и 500 J
Тъй като процесът е изометричен, няма промяна в обема, така че работата е нула.
Според първия закон на термодинамиката:
Тъй като е охлаждане, системата губи топлина, следователно:
въпрос 4
8 мола идеален газ в система бутало-цилиндър се компресират чрез извършване на 1000 J работа. По време на процеса се губят 400 J топлина във външната среда. Неговата вътрешна енергия и изменението на температурата му са съответно равни на
Дадено е: R = 8,31 J/mol. К
а) - 1400 J и приблизителна вариация от 6 K
б) 600 J и приблизителна вариация от 6 K
в) 600 J и приблизителна вариация от 14 K
d) - 1400 J и приблизителна вариация от 14 K
вътрешна енергия
Тъй като системата получава работа, нейният знак е отрицателен, както и топлината, която при този процес се губи.
Първият закон на термодинамиката е:
Като заместим стойностите, получаваме:
R = 8,31 J/mol K
температура
По закона на Джаул имаме:
въпрос 5
Перфектният газ претърпява компресия, като извършва работа с 500 J. В края на тази трансформация вътрешната енергия на системата се промени с 200 J по-малко, отколкото в началото. Количеството топлина, обменено от газа, беше
а) - 700 Дж
б) - 300 Дж
в) 300 J
г) 0J
д) 700 J
Тъй като работата е получена, тоест устойчива работа, нейният знак е отрицателен.
Заместване на стойностите в уравнението на първия закон на термодинамиката:
въпрос 6
(CEDERJ 2021) В етап от цикъла, изпълняван от идеален газ в климатик, налягането на газа се увеличава, като обемът му се поддържа постоянен. На този етап от цикъла работата W, извършена от газа, количеството топлина Q, погълната от него, и промяната ΔT в неговата температура са съответно:
а) W < 0, Q < 0 и ΔT < 0
б) W = 0, Q > 0 и ΔT > 0
в) W = 0, Q = 0 и ΔT = 0
г) W > 0, Q > 0 и ΔT > 0
Данни:
Налягането P се повишава;
Обемът остава постоянен;
работа
Тъй като обемът е постоянен, работата W е равна на нула.
Първият закон на термодинамиката е следният:
Тъй като топлината е положителна, промяната във вътрешната енергия също ще бъде положителна.
Топлина
Тъй като топлината се абсорбира, тя е положителна.
температура
По Закона за газа:
Където,
n е броят на бенките
R е универсалната газова константа
По този начин температурата зависи само от налягането, тъй като обемът е постоянен, като е положителен.
въпрос 7
(UNICENTRO 2018) Съгласно първия закон на термодинамиката, промяната във вътрешната енергия на система, ΔU, е дадено от разликата между обменената топлина с външната среда, Q, и работата, W, извършена в процеса термодинамика. Като се има предвид тази информация, ако моноатомен газ се разширява така, че винаги да остава при същата температура, тази трансформация може да бъде представена с уравнението
а) ΔU + W = 0
б) ΔU − W =0
в) Q − W = 0
г) Q + ΔU = 0
Изотермичният процес протича без промяна на температурата.
Енергията е свързана с температурата чрез:
Където n е броят молове, а R е универсалната газова константа. Тъй като n и R са постоянни, има само промяна на температурата и
Първият закон на термодинамиката е следният:
въпрос 8
(URCA 2016) Според първия закон на термодинамиката, ако по време на изотермичен процес, претърпян от идеален газ с фиксирана маса, газът се отделя количество топлина, чийто магнитуд е 50 cal, тогава промяната във вътрешната енергия и работата, извършена от газа в този процес, са, съответно:
а) 0 и 50 кал.
б) 50 кал и 0.
в) 0 и 0.
г) 50 кал и -50 кал.
д) 0 и -50 кал.
Промяната във вътрешната енергия е пряко свързана с промяната на температурата. Тъй като процесът е изотермичен, няма промяна на температурата, така че .
От първия закон на термодинамиката:
Тъй като се отделя топлина, нейният знак е отрицателен.
въпрос 9
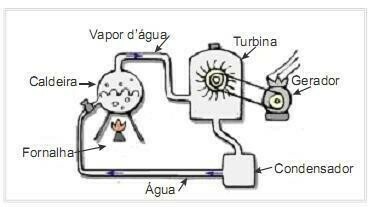
(UFRN 2012) Биомасата е един от основните източници на възобновяема енергия и следователно машините, които я използват като гориво за производство на електроенергия, са важни от екологична гледна точка. Много често срещан пример е използването на биомаса за задвижване на парна турбина за генериране на работа. Фигурата отстрани схематично показва опростена термоелектрическа централа.
В тази термоелектрическа централа изгарянето на биомаса в пещта произвежда топлина, която загрява водата в котела и генерира пара под високо налягане. Парата от своя страна се отвежда по тръби към турбината, която под нейно действие започва да върти лопатките си.
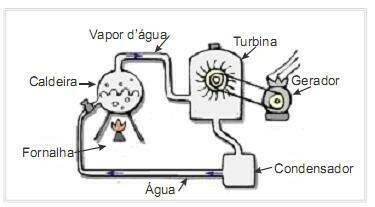
Да приемем, че топлинните загуби, дължащи се на температурни разлики между частите на този топлинен двигател и околната среда, са незначителни. В този контекст изменението на вътрешната енергия на котелната вода
а) е по-голяма от сумата на топлината, подадена към него от изгарянето на биомасата и работата, извършена върху турбината.
б) е равна на сумата от топлината, подадена към него от изгарянето на биомасата с работата, извършена върху турбината.
в) е равна на разликата между топлината, подадена към него от изгарянето на биомасата, и работата, извършена върху турбината.
г) е по-голяма от разликата между топлината, подадена към него от изгарянето на биомасата, и работата, извършена върху турбината.
Водата в котела получава енергия под формата на топлина от изгарянето на горивото и освобождава енергия под формата на работа, извършена върху турбината.
въпрос 10
(UECE 2021) По отношение на свойствата на газовете, обърнете внимание на следните твърдения:
аз За идеален газ вътрешната енергия е функция само на налягането.
II. Топлината, погълната от газ при промяна на състоянието му, не зависи от процеса.
III. Вътрешната енергия на идеален газ е функция само на температурата и не зависи от процеса.
IV. При изотермично разширение на идеален газ извършената от него работа е равна на погълнатата топлина.
Правилно е изложеното само в
а) I и II.
б) III и IV.
в) I и IV.
г) II и III.
III. ПРАВИЛНО. Вътрешната енергия на идеален газ е функция само на температурата и не зависи от процеса.
Промяната във вътрешната енергия е пряко свързана с промяната на температурата.
Където n е броят молове, а R е идеалната газова константа, тъй като е константа, само температурата определя вътрешната енергия на газа.
IV. ПРАВИЛНО. При изотермично разширение на идеален газ извършената от него работа е равна на погълнатата топлина.
Тъй като е изотермичен, няма промяна в температурата, така че промяната във вътрешната енергия е нула. По първия закон на термодинамиката:
Научете повече с:
- Първи закон на термодинамиката
- Термодинамика: закони, понятия, формули и упражнения
- Упражнения по термодинамика
- газов закон
ASTH, Рафаел. Упражнения по първия закон на термодинамиката.Цялата материя, [n.d.]. Достъпен в: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Достъп на:
Вижте също
- Упражнения по термодинамика
- Термодинамика
- адиабатна трансформация
- Упражнения по термохимия
- Първи закон на термодинамиката
- Естествени науки и техните технологии: Enem
- Термална енергия
- Втори закон на термодинамиката