โอ ปรับสมดุลสมการการลดการเกิดออกซิเดชัน มันขึ้นอยู่กับความเท่าเทียมกันของจำนวนอิเล็กตรอนที่มอบให้กับจำนวนอิเล็กตรอนที่ได้รับ วิธีง่าย ๆ ในการปรับสมดุลนี้มีให้โดยขั้นตอนต่อไปนี้:
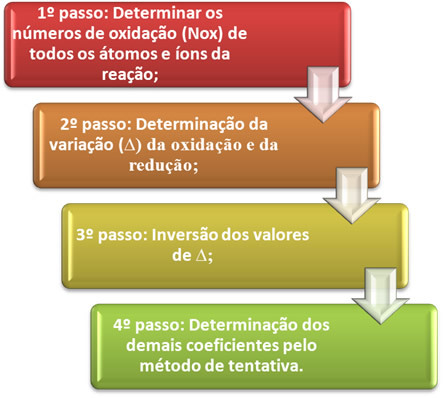
มาดูวิธีใช้งานขั้นตอนเหล่านี้ในทางปฏิบัติกัน โดยผ่านตัวอย่างต่อไปนี้:
ปฏิกิริยาระหว่างสารละลายโพแทสเซียมเปอร์แมงกาเนตและกรดไฮโดรคลอริกในน้ำ:
kmnO4 + HCl → KCl + MnCl2 + Cl2 + โฮ2โอ
*ก้าวแรก:กำหนดเลขออกซิเดชัน:
ขั้นตอนนี้มีความสำคัญเนื่องจากโดยปกติแล้วเราไม่สามารถนึกภาพได้อย่างรวดเร็วว่าสายพันธุ์ใดได้รับการออกซิเดชั่นและการลดลง
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
kmnO4 + HCl → KCl + MnCl2 + Cl2 + โฮ2โอ
*ขั้นตอนที่ 2:การหาค่าการเปลี่ยนแปลงการเกิดออกซิเดชันและการรีดักชัน:

โปรดทราบว่าแมงกานีส (Mn) จะลดลงและคลอรีน (Cl) จะถูกออกซิไดซ์
MnCl2 = ∆น็อกซ์ = 5
Cl2 = ∆น็อกซ์ = 2
ในกรณีของคลอรีน เราจะสังเกตได้ว่า HCl ทำให้เกิดสารประกอบ 3 อย่าง (KCl, MnCl2, และ Cl2) แต่สิ่งที่เราสนใจคือ Cl2, เพราะเป็น Nox ของคุณที่ได้รับการเปลี่ยนแปลง คลอรีนแต่ละตัวที่ก่อตัวเป็นCl2 สูญเสีย 1 อิเล็กตรอน; เนื่องจากต้องใช้คลอรีน 2 ตัวเพื่อสร้างCl2จากนั้นอิเล็กตรอนสองตัวจะหายไป
ขั้นตอนที่ 3:การผกผันของค่า ∆:
ในขั้นตอนนี้ ค่าของ ∆ จะถูกแลกเปลี่ยนระหว่างสปีชีส์ดังกล่าว กลายเป็นค่าสัมประสิทธิ์:
MnCl2 = ∆น็อกซ์ = 5 → 5 จะเป็นสัมประสิทธิ์ของCl2
Cl2 = ∆น็อกซ์ = 2→ 2 จะเป็นสัมประสิทธิ์ของ MnCl2
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + โฮ2โอ
ณ จุดนี้ เป็นไปได้ที่จะรู้สองสัมประสิทธิ์ของสมการแล้ว
การสังเกต: โดยปกติ ในปฏิกิริยาส่วนใหญ่ การกลับค่านี้จะดำเนินการกับสมาชิกที่ 1 แต่ตามกฎทั่วไป ควรทำในสมาชิกที่มีจำนวนอะตอมมากที่สุดที่ได้รับการรีดอกซ์ หากไม่เป็นไปตามเกณฑ์นี้ เราจะกลับค่าสำหรับสมาชิกที่มีจำนวนสปีชีส์เคมีสูงสุด นี่คือสิ่งที่ทำที่นี่เนื่องจากสมาชิกคนที่ 2 มีสารมากขึ้น
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
ขั้นตอนที่ 4: ทดลองปรับสมดุล:
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + โฮ2โอ
- เนื่องจากในสมาชิกที่สองมีอะตอมของแมงกานีสสองอะตอมดังแสดงโดยสัมประสิทธิ์ในอะตอมแรกด้วย ดังนั้นเราจึงมี:
2 kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + โฮ2โอ
- ดังนั้นปริมาณโพแทสเซียม (K) ในสมาชิกที่ 1 คือ 2 ซึ่งจะเป็นค่าสัมประสิทธิ์เดียวกันสำหรับอะตอมนี้ในสมาชิกที่สอง:
2 kmnO4 + HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + โฮ2โอ
- ปริมาณคลอรีน (Cl) ในสมาชิกที่ 2 เท่ากับ 16 ดังนั้นค่าสัมประสิทธิ์ HCl ของสมาชิกที่ 1 จะเป็นดังนี้
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + โฮ2โอ
- จำนวนไฮโดรเจนในองค์ประกอบที่ 1 คือ 16 ดังนั้นสัมประสิทธิ์ของน้ำ (H2O) ของสมาชิกที่ 2 จะเท่ากับ 8 เนื่องจากการคูณของดัชนีไฮโดรเจน (2) ด้วย 8 เท่ากับ 16:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 โฮ2โอ
- ในการตรวจสอบว่าสมการมีความสมดุลอย่างถูกต้องหรือไม่ เราสามารถเห็นเกณฑ์สองประการ:
1) ตรวจสอบว่าแต่ละอะตอมมีปริมาณเท่ากันหรือไม่:
2 kmnO4 + 16 HCl →2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2โอ
K =2K =2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
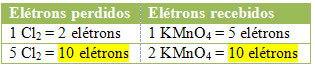
2) ดูว่าจำนวนอิเล็กตรอนที่สูญหายทั้งหมดเท่ากับจำนวนอิเล็กตรอนที่ได้รับทั้งหมดหรือไม่:
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
โฟกาซ่า, เจนนิเฟอร์ โรชา วาร์กัส "สมดุลลด Roxi"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm. เข้าถึงเมื่อ 28 มิถุนายน 2021.