THE ค่าคงที่ไอออไนซ์ ให้ น้ำ(กิโลวัตต์), อู๋ ศักยภาพของไฮโดรเจน(พีเอช) มันเป็น ศักยภาพของไฮดรอกซิไลโอนิก (พีโอเอช) พวกเขาเป็น มาตรการ สำคัญสำหรับการคำนวณที่เกี่ยวข้องกับ สมดุลเคมี ในสารละลายที่เป็นกรดและด่างตลอดจนในการกำหนดความเข้มข้นของ H ไอออน+ และโอ้- ของโซลูชันที่เป็นปัญหา
Kw คืออะไร?
ผลิตภัณฑ์ไอออนิกของน้ำหรือ Kw (นี้ wหมายถึง น้ำ — น้ำ ในภาษาอังกฤษ) เป็นค่าคงที่ที่ใช้แทน ความสมดุลที่เกิดจากการทำให้น้ำแตกตัวเป็นไอออนในตัวเอง. แม้ในอัตราที่น้อยมาก น้ำแตกตัวเป็นไอออนก็ผลิต H ไอออน+ และโอ้-ตามสมการเคมีต่อไปนี้
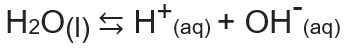
เมื่อวิเคราะห์สมการแล้ว เราพบว่าเมื่อ ไอออไนซ์ จากโมเลกุลของน้ำบริสุทธิ์จะทำให้เกิดไอออน H+ และ OH ไอออน-, นั่นคือ ความเข้มข้นของไอออนเหล่านี้จะเท่ากันเสมอ. แม้ว่าจะมีอุณหภูมิเพิ่มขึ้นซึ่งทำให้อัตราการแตกตัวเป็นไอออนเพิ่มขึ้น ความเข้มข้นก็ยังคงเท่าเดิม
อ่านด้วย:พลังงานไอออไนซ์
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
จากการวัดในการทดลอง คำนวณความเข้มข้นของ H ไอออน+ และโอ้- (เกิดจาก self-ionization ของน้ำ) ที่อุณหภูมิ 25°C และค่า 1. 10-7 นางสาว. นั่นคือ, ของโมเลกุลน้ำทั้งหมด 1 พันล้านโมเลกุล
, เท่านั้น สองได้รับไอออไนซ์. นี่แสดงให้เห็นว่าน้ำบริสุทธิ์มีระดับไอออนไนซ์ต่ำและอธิบายค่าที่ต่ำมาก การนำไฟฟ้า ของน้ำบริสุทธิ์พิจารณาสิ่งที่แสดงข้างต้น เราสามารถเขียน write การแสดงออก ของค่าคงที่สมดุลของน้ำ:

การใช้ค่าความเข้มข้นของไอออน H+ และโอ้- ที่อุณหภูมิ 25 องศาเซลเซียส เราสามารถคำนวณหาค่า K. ได้w:
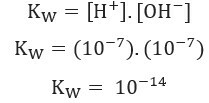
ตามที่ระบุไว้ก่อนหน้านี้ค่านี้ของ Kw เปลี่ยนแปลงตามอุณหภูมิที่เพิ่มขึ้นดังแสดงในตารางด้านล่าง:
ที (°ซ) |
Kw |
10 |
0,29. 10-14 |
20 |
0,68. 10-14 |
25 |
1,00. 10-14 |
30 |
1,47. 10-14 |
40 |
2,92. 10-14 |
60 |
9,40. 10-14 |
หากต้องการเรียนรู้เพิ่มเติมเกี่ยวกับเรื่องนี้ โปรดอ่านข้อความของเรา: ผลิตภัณฑ์น้ำอิออน.
pH และ pOH คืออะไร?

ตัวย่อ pH หมายถึง ศักยภาพของไฮโดรเจน และถูกสร้างขึ้นโดยนักชีวเคมีชาวเดนมาร์ก โซเรน โซเรนเซ่น, ในปี พ.ศ. 2452 เพื่ออำนวยความสะดวกในการทำงานกับ ความเข้มข้นของไฮโดรเจนไอออน [ห้+] ซึ่งมักจะแสดงเป็นเลขฐานสิบ หากต้องการเรียนรู้เพิ่มเติมเกี่ยวกับหัวข้อนี้ โปรดอ่านข้อความของเรา: pH คืออะไร?
สัญกรณ์แบบนี้ บ่งชี้เนื้อหา H ไอออน+ มีอยู่ในสารละลาย และถูกกำหนดโดยนิพจน์ทางคณิตศาสตร์:
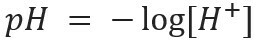
ในทำนองเดียวกัน เราสามารถกำหนด pOH หรือศักย์ไฮดรอกซีไลออนิก ซึ่งบอกเราว่า ปริมาณไอออน OH- มีอยู่ในสารละลาย. นิพจน์ทางคณิตศาสตร์ของมันคือ:
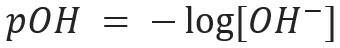
ในสารละลายที่เป็นน้ำจะมี H ไอออนเสมอ+ และโอ้- (เนื่องจากการไอออไนซ์ที่ได้รับผลกระทบจากน้ำ) ที่จะนำมาใช้เพื่อกำหนดลักษณะของสารละลายใน กรด หรือ ขั้นพื้นฐาน. ไอออน H มากขึ้น+ มีอยู่ในสารละลายยิ่งมีความเป็นกรดมากขึ้น ดังนั้นการมีอยู่ของ OH ไอออน- ในการแก้ปัญหาจะทำให้เป็นพื้นฐานมากขึ้น หากมีความสมดุลในปริมาณของไอออนเหล่านี้ สารละลายจะถูกจำแนกเป็น เป็นกลาง.
มาตราส่วน pH
มาตราส่วน pH จะแสดงด้วยค่าตั้งแต่ 0 ถึง 14 (ค่าที่วัดที่ 25°C) ดูมาตราส่วน pH ในภาพด้านล่าง:

ยิ่ง pH ต่ำของสารละลายความเป็นกรดของมันยิ่งใหญ่กว่า และยิ่งใกล้จุดสิ้นสุดของมาตราส่วน นั่นคือ ยิ่งเข้าใกล้ 14 อักขระพื้นฐานก็จะยิ่งมากขึ้น ตัวอย่างเช่น น้ำมะนาวมีค่า pH 2 ในขณะที่สารฟอกขาวมีค่า pH 12
วิธีการคำนวณค่า pH และ pOH
รู้จัก ความเข้มข้นของไอออน, เราทำได้ คำนวณค่า ของ pH และ pOH ของสารละลาย และเมื่อทราบค่าที่เป็นไปได้ เราจะคำนวณ calculate ความเข้มข้นของไอออนในสารละลาย. เพื่อจุดประสงค์นี้จะใช้นิพจน์ต่อไปนี้:
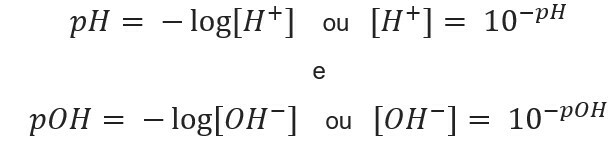
ไปที่ตัวอย่าง:
ตัวอย่าง 1
หากเราต้องการทราบค่า pH ของสารละลายด้วย [H+] = 0.001 mol/L เพียงใช้สูตรที่นำเสนอก่อนหน้านี้:
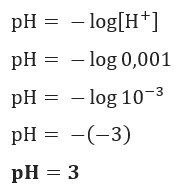
ตัวอย่าง 2
ทีนี้มาดูว่าความเข้มข้นของ OH. คืออะไร- ของสารละลายที่มี pOH = 5 เพียงแทนที่ค่าในสูตรต่อไปนี้:

ถ้าเราใช้มาตราส่วนศักย์เดียวกันสำหรับความสมดุลของไอออนิกของน้ำ เราจะมี:
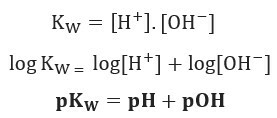
ตามที่ระบุไว้ ที่ 25 องศาเซลเซียส Kw = 10-14. ดังนั้น:

ด้วยวิธีนี้ เราสามารถคำนวณ pOH ของสารละลายตามค่า pH ของมันได้ ถ้าเรามีสารละลายที่มีค่า pH 3 แล้ว pOH ของมันจะเป็น 11
เรียนรู้เพิ่มเติม: สื่อกลาง กรด และเบส
แบบฝึกหัดแก้ไข
คำถามที่ 1 (UEFS-BA) ความเข้มข้นของไอออน OH–(ที่นี่) ในสารละลายแอมโมเนียมไฮดรอกไซด์ที่กำหนด ที่อุณหภูมิ 25 °C เท่ากับ 1.10–3 นางสาว. pOH ของโซลูชันนี้คือ:
ก) 0
ข) 1
ค) 3
ง) 11
จ) 13
ความละเอียด: จดหมาย C. ถ้าเรามี [OH–] = 10–3 mol/L ดังนั้น pOH ของคุณจะเท่ากับ 3
ดู:
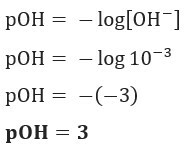
คำถามที่ 2 (UEA-AM) พิจารณาข้อมูลต่อไปนี้ ซึ่งได้จากฉลากน้ำแร่ในเมือง Porto Seguro (BA):
ไนเตรต 1.45 มก./ลิตร
pH ที่ 25°C 4.51
น้ำแร่นี้คือ
ก) เป็นกรดและมี [H+] < [OH–].
b) เป็นกรดและมี [H+] > [OH–].
c) เป็นกลางและมี [H+] = [OH–].
d) พื้นฐานและมี [H+] > [OH–].
จ) พื้นฐานและมี [H+] < [OH–].
ความละเอียด: จดหมายข. เนื่องจากค่า pH ของน้ำแร่ที่แจ้งบนฉลากมีค่าน้อยกว่า 7 เราจึงสามารถพูดได้ว่ามันเป็นสารละลายที่เป็นกรด ดังนั้นความเข้มข้นของไอออน H+ ใหญ่กว่า OH's-.
คำถามที่ 3 (UEA-AM) วิธีหนึ่งในการผลิตก๊าซไฮโดรเจนอย่างรวดเร็วในห้องปฏิบัติการคือทำปฏิกิริยากับสังกะสีที่เป็นผงกับกรดไฮโดรคลอริก (HCl) ที่ความเข้มข้น 1.0 โมลต่อลิตร:
สังกะสี (s) + 2 HCl (aq) → ZnCl2 (aq) + H2 (ช)
เมื่อพิจารณาว่ากรดไฮโดรคลอริกนั้นแตกตัวเป็นไอออน 100% และสารละลายอยู่ที่ 25°C ถูกต้องที่จะระบุว่า pH ของสารละลายกรดไฮโดรคลอริกที่กล่าวถึงในข้อความคือ
- 0
- 1
- 3
- 13
- 14
ความละเอียด:จดหมาย. เราสามารถคำนวณค่า pH ของสารละลายโดยใช้ความเข้มข้นของ HCl ที่แจ้งในข้อความ เนื่องจากความเข้มข้นของ [H+] จะเหมือนกันเพราะสำหรับโมเลกุล HCl ที่แตกตัวเป็นไอออนแต่ละโมเลกุล H ไอออนหนึ่งตัว+ จะถูกสร้างขึ้น ดังนั้น:
โดย Victor Ferreira Ferr
ครูสอนเคมี