THE ค่าคงที่การไฮโดรไลซิส (Kh) หมายถึง a สมดุลเคมี เกิดขึ้นจากการไฮโดรไลซิสของเกลือ (ปฏิกิริยาเคมีที่เกี่ยวข้องกับเกลือและน้ำที่ละลายน้ำได้)
เป็นค่าคงที่ของสมดุลอื่นใด นิพจน์ของ ค่าคงที่การไฮโดรไลซิส สร้างจากผลคูณของความเข้มข้นของผลิตภัณฑ์หารด้วยผลคูณของความเข้มข้นของรีเอเจนต์ดังนี้
ค = [ผลิตภัณฑ์]
[รีเอเจนต์]
การทำงานกับค่าคงที่ไฮโดรไลซิสเกี่ยวข้องกับความรู้เกี่ยวกับปรากฏการณ์สำคัญสามประการ:
- การแยกตัวของเกลือ;
- น้ำแตกตัวเป็นไอออน;
- การไฮโดรไลซิสของเกลือ
การแยกตัวของเกลือ
เมื่อเติมเกลือที่ละลายน้ำได้ เกลือจะแยกตัวออกจากกันและปล่อยไอออนบวกออกมานอกเหนือจากไฮโดรเนียม (H+) และแอนไอออนอื่นที่ไม่ใช่ไฮดรอกซิล (OH-)

เพื่อเตือนคุณเมื่อเกลือเป็นหรือไม่ละลายในน้ำ คลิกที่นี่ และศึกษาตารางการละลายเกลือ
น้ำแตกตัวเป็นไอออน
น้ำเป็นสารที่ผ่านปรากฏการณ์ของการแตกตัวเป็นไอออนในตัวเองโดยธรรมชาติ กล่าวคือ มันผลิตไฮโดรเนียมไอออนบวกและไฮดรอกซิลแอนไอออน
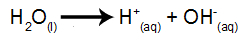
สมการไอออไนซ์ของน้ำ
ไฮโดรไลซิสของเกลือ
ในฐานะที่เป็นเกลือที่ละลายน้ำได้ มันจะปล่อยไอออนออกสู่น้ำ และน้ำจะถูกทำให้แตกตัวเป็นไอออน ทำให้เกิด ไอออน ตรงกลาง ปฏิกิริยา (ไฮโดรไลซิส) ระหว่างเกลือไอออนกับไอออนของน้ำสามารถเกิดขึ้นได้ เมื่อเกิดปฏิกิริยานี้ ปฏิกิริยาที่เป็นไปได้คือ:
- ไอออนบวกของเกลือกับไอออนของน้ำ (การก่อตัวของเบส);
- ไอออนของเกลือกับไอออนบวกของน้ำ (การก่อตัวของเกลือ);
ปฏิกิริยาข้างต้นจะเกิดขึ้นก็ต่อเมื่อเบสหรือกรดก่อตัวอ่อน
ดูตัวอย่างของการไฮโดรไลซิสของเกลือ:
→ ไฮโดรไลซิสของแอมโมเนียมไฮโปคลอไรท์ (NH4ClO)
เมื่อเติมแอมโมเนียมไฮโปคลอไรท์ลงในน้ำ มันจะละลายและแยกตัวออกจากกัน โดยปล่อยไอออนไอออนบวกของแอมโมเนียม (NH4+) และไอออนไฮโปคลอไรท์ (ClO-):

สมการแสดงไอออนที่ปล่อยออกมาจากการแตกตัวของแอมโมเนียมไฮโปคลอไรท์
เมื่อน้ำถูกทำให้แตกตัวเป็นไอออน จะผลิต H+ และ OH- เรามีไอออนบวก 2 ตัวและแอนไอออน 2 ตัวในสารละลาย ซึ่งสามารถทำปฏิกิริยาได้ ไอออนบวกของ NH4+ ทำปฏิกิริยากับ OH- แอนไอออนเท่านั้นเนื่องจากเป็นเบสอ่อน (NH4OH) ClO- แอนไอออนทำปฏิกิริยากับไอออนบวก H+ เท่านั้น เนื่องจากจะสร้างกรดอ่อน (HClO)

สมการสมดุลไฮโดรไลซิสของแอมโมเนียมไฮโปคลอไรท์
การสร้างนิพจน์ของค่าคงที่ไฮโดรไลซิส
การสร้างค่าคงที่ไฮโดรไลซิสของเกลือขึ้นอยู่กับสมการไฮโดรไลซิสสำหรับเกลือนั้นโดยเฉพาะ ตัวอย่างเช่น การไฮโดรไลซิสของแอมโมเนียมไฮโปคลอไรท์ในข้อที่แล้ว ทำให้เกิดสมการต่อไปนี้:

สมการสมดุลไฮโดรไลซิสของแอมโมเนียมไฮโปคลอไรท์
วิธีสร้างนิพจน์ของ ค่าคงที่การไฮโดรไลซิส พิจารณาผลิตภัณฑ์และรีเอเจนต์ นิพจน์ของค่าคงที่จะเป็น:
ค = [HClO][NH4OH]
[ClO-].[NH4+]
หมายเหตุ: น้ำไม่มีส่วนร่วมในสมการเพราะเป็นรีเอเจนต์เหลวและเนื่องจากเป็นวิธีการพื้นฐานสำหรับการไฮโดรไลซิส นั่นคือ เป็นค่าคงที่
By Me. ดิโอโก้ โลเปส ดิอาส
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-constante-hidrolise.htm
