เพื่อให้เกิดปฏิกิริยาเคมี จำเป็นต้องปฏิบัติตามเงื่อนไขพื้นฐาน 4 ประการ ได้แก่
1. รีเอเจนต์ต้องติดต่อ
2. ต้องมีความสัมพันธ์ทางเคมีระหว่างรีเอเจนต์
3. การชนกันระหว่างอนุภาครีเอเจนต์ต้องมีประสิทธิภาพ
4. พลังงานกระตุ้นจะต้องถึง
ดูแต่ละกรณีโดยย่อ:
1.การติดต่อระหว่างรีเอเจนต์:
เงื่อนไขนี้ชัดเจน เพราะแม้ว่าสารตั้งต้นจะมีความสัมพันธ์ซึ่งกันและกันมาก เช่นในกรณีของกรดและเบส หากแยกจากกัน ปฏิกิริยาจะไม่เกิดขึ้น พวกเขาจำเป็นต้องสัมผัสกันเพื่อให้อนุภาคสามารถชนกัน ทำลายพันธะของสารตั้งต้น และเกิดพันธะของผลิตภัณฑ์

2.ความสัมพันธ์ทางเคมี:
ดังที่เราได้เห็นแล้วว่า การนำรีเอเจนต์มาสัมผัสเป็นสิ่งที่จำเป็น แต่ไม่เพียงพอ ตัวอย่างเช่น ถ้าเราใส่โซเดียมลงในน้ำ จะเกิดปฏิกิริยารุนแรงขึ้น แต่ถ้าเราใส่ทอง เราจะไม่เห็นความแตกต่างใดๆ เนื่องจากสารต่าง ๆ มีความสัมพันธ์ทางเคมีที่ต่างกัน หรืออาจไม่มีความสัมพันธ์กันเลย ยิ่งมีความสัมพันธ์ทางเคมีมากเท่าใด ปฏิกิริยาก็จะยิ่งเร็วขึ้นเท่านั้น
ในตัวอย่างที่กล่าวถึง โซเดียมมีความเกี่ยวพันกับน้ำอย่างมาก เพื่อไม่ให้สัมผัสกับความชื้นในอากาศ โซเดียมที่เป็นโลหะจะถูกเก็บไว้ในน้ำมันก๊าด ทองคำเป็นสิ่งเฉื่อย ซึ่งเป็นสาเหตุที่ทำให้อนุสาวรีย์ทองคำมีอายุยืนยาว เช่น โลงศพของอียิปต์

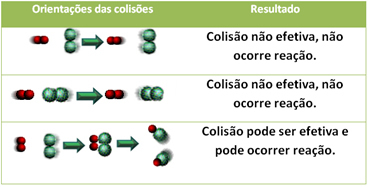
3.ทฤษฎีการชนกัน:
แม้แต่ในสารประกอบที่มีความสัมพันธ์ทางเคมี ปฏิกิริยาที่จะเกิดขึ้นก็จำเป็นที่อนุภาค อะตอม หรือโมเลกุลของพวกมันจะชนกันอย่างมีประสิทธิภาพ ไม่ใช่อนุภาคทั้งหมดที่ชนกันอย่างมีประสิทธิภาพ แต่แรงกระแทกที่ส่งผลให้เกิดการทำลายbreaking พันธะรีเอเจนต์และการก่อตัวของพันธะใหม่คือพันธะที่เกิดขึ้นในทิศทางที่ถูกต้องและด้วยพลังงาน พอ.
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
ด้านล่างนี้คือกรณีของการชนกันที่ไม่มีประสิทธิภาพสองครั้งและการชนกันที่มีประสิทธิผลหนึ่งครั้งซึ่งส่งผลให้เกิดปฏิกิริยาเกิดขึ้น
4.พลังงานกระตุ้นและคอมเพล็กซ์ที่เปิดใช้งาน:
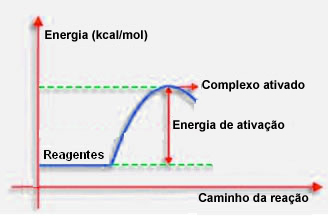
ตามที่ระบุไว้ในรายการก่อนหน้า การชนกันอย่างมีประสิทธิภาพ นอกจากแนวทางที่ดีแล้ว ยังต้องการพลังงานที่เพียงพออีกด้วย ปริมาณพลังงานขั้นต่ำที่จำเป็นสำหรับปฏิกิริยาแต่ละครั้งเรียกว่าพลังงานกระตุ้น
ถ้าสารตั้งต้นมีพลังงานเท่ากับหรือมากกว่าพลังงานกระตุ้น ในระหว่างการกระแทกที่ปรับทิศทางได้ดี สารเชิงซ้อนที่ถูกกระตุ้นในขั้นต้นจะก่อตัวขึ้น ซึ่งเป็นโครงสร้างขั้นกลางระหว่างสารตั้งต้นและ สินค้า. ในสารเชิงซ้อนที่ถูกกระตุ้น จะมีพันธะสารตั้งต้นที่อ่อนตัวลงและเกิดพันธะผลิตภัณฑ์ใหม่ขึ้น
ดังนั้นพลังงานกระตุ้นจะทำงานเป็นอุปสรรคสำหรับปฏิกิริยาที่จะเกิดขึ้น เพราะยิ่งมีขนาดใหญ่เท่าใด ปฏิกิริยาจะเกิดขึ้นได้ยากขึ้นเท่านั้น ในบางกรณี จำเป็นต้องจ่ายพลังงานให้กับรีเอเจนต์ ตัวอย่างเช่น แก๊สหุงต้มมีความสัมพันธ์กับออกซิเจนในอากาศ แต่เราจำเป็นต้องจัดหาพลังงานเมื่อเรานำไม้ขีดมารวมกัน มิฉะนั้น ปฏิกิริยาจะไม่เกิดขึ้น แต่เมื่อเริ่มต้น ปฏิกิริยาจะปล่อยพลังงานมากพอที่จะกระตุ้นโมเลกุลอื่นๆ และทำให้ปฏิกิริยาดำเนินต่อไป
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
โฟกาซ่า, เจนนิเฟอร์ โรชา วาร์กัส "เงื่อนไขการเกิดปฏิกิริยาเคมี"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm. เข้าถึงเมื่อ 27 มิถุนายน 2021.



