โอ pH ของสารละลายระบุเนื้อหา (การวัด) ของไฮโดรเนียมไอออน (H3โอ+) อยู่ตรงกลาง เนื้อหานี้กำหนดว่าสารละลายที่วิเคราะห์มีลักษณะเป็นกรด เบส หรือเป็นกลาง
การสังเกต: เป็นที่น่าสังเกตว่าเนื้อหาของไฮโดรเนียม (H3โอ+ หรือ H+) สามารถหาซื้อได้ง่ายๆ ในห้องปฏิบัติการโดยใช้เทปวัดค่า pH ซึ่งไม่มีความแม่นยำมากนัก ในการวัด - หรือโดยใช้อุปกรณ์ที่เรียกว่า peagometer ซึ่งตรงกันข้ามมีความแม่นยำมากในการวัดค่า pH ของ a สารละลาย.
Pedometer หรือ Potentiometer เพื่อวัดค่า pH ของสารละลาย
เพื่อดำเนินการ การคำนวณที่เกี่ยวข้องกับ pH ของการแก้ปัญหา เราสามารถใช้สมการลอการิทึมต่อไปนี้:
pH = - บันทึก [H3โอ+]
หรือ
pH = - บันทึก [H+]
สำคัญ: ในการคำนวณที่เกี่ยวข้องกับ pH ของสารละลาย เราใช้ลอการิทึมฐาน 10 เสมอ
Mind Map: การคำนวณค่า PH ของโซลูชัน

* ในการดาวน์โหลดแผนที่ความคิดในรูปแบบ PDF คลิกที่นี่!
จากสมการลอการิทึมด้านบน เรายังสามารถใช้การแจกแจงแบบง่าย (ได้มาจากการใช้ฟังก์ชันลอการิทึม) ของสมการนี้:
[ห้3โอ+] = 10-pH
การสังเกต: นิพจน์แบบง่ายข้างต้นสามารถใช้ได้เฉพาะเมื่อค่า pH เป็นจำนวนเต็ม มิฉะนั้น จะต้องใช้ฟังก์ชันลอการิทึม
สิ่งสำคัญคือต้องเน้นว่าการคำนวณที่เกี่ยวข้องกับ pH ของสารละลายนั้นเกี่ยวข้องกับ pOH เสมอ (ศักย์ไฮดรอกซิไลออน / OH
-) เนื่องจากความแรงทั้งสองนั้นขึ้นอยู่กับการทำให้น้ำแตกตัวเป็นไอออนในตัวเอง (Kw = 10-14เป็นปรากฏการณ์ที่น้ำผลิต H. ได้มาก+ เท่าไหร่ค่ะ-) และกฎการเจือจางของ Ostwald (ยิ่งสารละลายเจือจางมากเท่าใด ปริมาณของ H cations ก็จะยิ่งมากขึ้น+ ). ดังนั้น:เกี่ยวกับ การทำให้เป็นน้ำอัตโนมัติ:
Kw = [H+]. [โอ้-] ดังนั้น pH + pOH = 14
กฎหมายของ การเจือจาง Ostwald(จากข้อมูลนี้ เราสามารถรู้ได้ว่าสารบางชนิดแตกตัวเป็นไอออนหรือแตกตัวในน้ำได้มากเพียงใด):
Kผม = ม.α2
Ki = ค่าคงที่ไอออไนเซชันของสารในตัวกลางที่เป็นน้ำ
M = โมลาริตีหรือความเข้มข้นของโมลาร์ของสารในตัวกลางที่เป็นน้ำ
α2 = ระดับของไอออไนซ์หรือการแยกตัวของวัสดุในตัวกลาง
การจำแนกประเภทของสารละลายเป็นกรด เบส หรือเป็นกลางจะมีเกณฑ์ดังต่อไปนี้ (a 25 โอค):
-
หนึ่ง สารละลายจะเป็นกลาง เมื่อความเข้มข้นของ H+ เท่ากับความเข้มข้นของ OH- หรือมีค่า pH เท่ากับ 7
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
[ห้+] = [OH-]
หนึ่ง สารละลายจะเป็นกรด เมื่อความเข้มข้นของ H+ มากกว่าความเข้มข้นของ OH- หรือ pH อยู่ระหว่าง 0 ถึง 7
[ห้+] > [OH-]
หนึ่ง การแก้ปัญหาจะเป็นพื้นฐาน เมื่อความเข้มข้นของ H+ น้อยกว่าความเข้มข้นของ OH- หรือ pH อยู่ระหว่าง 7 ถึง 14
[ห้+] < [OH-]
ดูตัวอย่างการคำนวณที่เกี่ยวข้องกับ pH ของสารละลาย:
1º)รู้ว่าความเข้มข้นของไฮโดรเนียมในกาแฟมีค่าเท่ากับ 1.10-5, ค่า pH จะเป็นอย่างไรในสารละลายนี้?
วิธีออกกำลังกาย ให้ความเข้มข้นของไฮโดรเนียม สำหรับกาแฟเราก็ทำได้ ใช้สูตร pH แบบง่าย:
[ห้3โอ+] = 10-pH
1.10-5 = 10-pH
10-5 = 10-pH
-5 = -pH
pH = 5
เนื่องจาก pH น้อยกว่า 7 สารละลายจึงเป็นกรด
2º) (ยูเอฟยู) pH ของสารละลายกรดอะซิติก 0.045 โมล/ลิตร สมมติว่าเป็น Kผม = 1,.10-5? ข้อมูล: บันทึก 2 = 0.3; บันทึก 3 = 0.48
ข้อมูลการออกกำลังกาย:
M = 0.045 โมล/ลิตร
Kผม = 1,8.10-5
บันทึก 2 = 0.3
บันทึก 3 = 0.48
วิธีการออกกำลังกายให้ โมลาริตี (M) และค่าคงที่ไอออไนซ์ (Kผม),ขั้นแรก เรามากำหนดระดับการแตกตัวเป็นไอออนของกรดที่กล่าวถึงกันก่อน เพราะความเข้มข้นของไฮโดรเนียม (H3โอ+ หรือ H+) เป็นผลจากการคูณระหว่างโมลาริตีและระดับของการแตกตัวเป็นไอออนเสมอ เร็ว ๆ นี้:
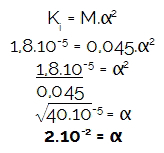
ต่อไป มาคำนวณ ปริมาณไฮโดรเนียมคูณโมลาริตี ของกรดตามระดับของไอออไนซ์ที่พบ:
[ห้3โอ+] = ม.α
[ห้3โอ+] = 0,045.2.10-2
[ห้3โอ+] = 0,09.10-4
[ห้3โอ+] = 9.10-4 นางสาว
สุดท้ายเราใส่ ค่าความเข้มข้นของไฮโดรเนียมในสมการ pH ลอการิทึม:
pH = - บันทึก [H3โอ+]
pH = - บันทึก 9.10-4
pH = 4 - บันทึก 9
pH = 4-log 32
pH = 4 - 2 (บันทึก 3)
pH = 4- (2.0.48)
pH = 4-0.96
pH = 3.04
เนื่องจาก pH น้อยกว่า 7 สารละลายจึงเป็นกรด
3º)(Cefet-PR) A 45 โอC, Kw ของสารละลายเป็นกลางเท่ากับ 4.10-4. แล้วค่า pH ของสารละลายที่อุณหภูมินี้มีค่าเท่าใด? ข้อมูลล็อก 2 = 0.3
วิธีการออกกำลังกายบอกคุณวิธีแก้ปัญหาคือ เป็นกลาง, เร็วๆ นี้ [ห้3โอ+] เท่ากับ [OH-]:

สุดท้ายเราใส่ ค่าความเข้มข้นของไฮโดรเนียมในสมการ pH ลอการิทึม:
pH = - บันทึก [H+]
pH = - บันทึก 2.10-7
pH = 7 - บันทึก 2
pH = 7-0.3
pH = 6.7
เนื่องจาก pH เกือบ 7 สารละลายจึงเป็นกลาง (ตามที่ระบุไว้ในคำชี้แจงการฝึกปฏิบัติ) เนื่องจากอุณหภูมิอยู่ที่ 45 โอค.
By Me. Diogo Lopes Dias
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
DAYS ดิโอโก้ โลเปส "การคำนวณเกี่ยวกับ pH ของสารละลาย"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/calculos-envolvendo-ph-solucoes.htm. เข้าถึงเมื่อ 28 มิถุนายน 2021.
กฎของ Ostwald, ค่าคงที่ไอออไนซ์, ความเข้มข้นของโมลาร์, ระดับของไอออไนซ์, อิเล็กโทรไลต์อ่อน, จำนวนโมลไอออไนซ์, ฟรีดริช วิลเฮล์ม ออสต์วาลด์, กรดเดี่ยว, โมโนเบส