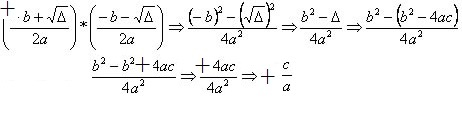ในกิจกรรมกีฬา ในโรงพยาบาล และในชีวิตประจำวันของเรา การใช้ประคบร้อนและเย็นเป็นเรื่องปกติมาก ในทั้งสองกรณี สารบางชนิดทำปฏิกิริยากับน้ำ ตัวอย่างเช่น ในกรณีของการประคบเย็น มีสองแคปซูลแยกน้ำออกจาก NH4ที่3ซึ่งเมื่อละลายในน้ำจะดูดซับความร้อนและทำให้เกิดความเย็นทันที ในกรณีประคบร้อน CaCl จะละลายในน้ำ2 หรือ MgSO4ซึ่งปล่อยพลังงานความร้อนออกมา
แต่ เหตุใดสารละลายบางชนิดจึงปล่อยความร้อนออกมาเป็นคายความร้อน และคนอื่นดูดซับดูดความร้อน?
เพื่อจะเข้าใจปัญหานี้เราต้องศึกษา study การเปลี่ยนแปลงเอนทัลปี (ΔH) ของสารละลาย ofซึ่งประกอบด้วยสองขั้นตอน:
(1) เอนทาลปีตาข่าย (ΔHย้อนเวลา): เมื่อตัวถูกละลายละลายในน้ำ ขั้นตอนแรกคือการแยกไอออนที่อยู่ในตาข่ายผลึก เพื่อทำลายพันธะระหว่างไอออนจำเป็นต้องจ่ายพลังงานให้กับระบบ ดังนั้นขั้นตอนแรกนี้คือ ดูดความร้อนเพราะมันดูดซับพลังงาน เป็นของคุณ เอนทาลปีบวก (ΔH > 0)

(2nd) Enthalpy ของความชุ่มชื้น (ΔHซ่อน): หลังจากที่อิออนแยกตัวออกจากกัน พวกมันจะถูกห่อหุ้มด้วยโมเลกุลของตัวทำละลาย ในกรณีของน้ำ มันคือตัวทำละลายและเราบอกว่าไฮเดรชั่นกำลังเกิดขึ้น ไดโพลของน้ำจะถูกดึงดูดโดยไอออนที่มีประจุตรงข้ามตามลำดับ ดังนั้นสำหรับปฏิสัมพันธ์นี้จึงจำเป็นต้องมีการปลดปล่อยพลังงาน ดังนั้นในการให้ความชุ่มชื้น
เอนทาลปีจะเป็นลบ (ΔH < 0)เพราะกระบวนการคือ คายความร้อน.รูปด้านล่างแสดงให้เห็นว่าไฮเดรชั่นเกิดขึ้นได้อย่างไร ซึ่งมีอันตรกิริยาระหว่างไอออนกับไดโพล กล่าวคือ แรงดึงดูดระหว่างประจุของไอออนที่แยกจากกันกับไดโพลน้ำ:

การเปลี่ยนแปลงเอนทาลปีของสารละลาย (ΔHอา) จะถูกกำหนดโดยผลรวมของเอนทาลปีทั้งสองนี้ หากผลลัพธ์เป็นบวก แสดงว่าเอนทาลปีตาข่ายสูงขึ้น ดังนั้นเอนทาลปีการละลายจะบ่งชี้ว่ากระบวนการดูดความร้อน
แผนภาพเอนทาลปีของการละลายดูดความร้อนแสดงไว้ด้านล่าง:

นี่แสดงให้เห็นโดยกรณีของการละลายโพแทสเซียมไอโอไดด์ที่แสดงด้านล่าง:

แผนภาพเอนทาลปีของคุณจะแสดงโดย:

หากผลลัพธ์เป็นบวก เอนทาลปีของไฮเดรชั่นจะมากกว่าแบบไขว้กันเหมือนแห และกระบวนการนี้เป็นแบบคายความร้อน แผนภาพเอนทาลปีของการละลายแบบคายความร้อนแสดงดังแสดงในตัวอย่างต่อไปนี้:


สังเกตไดอะแกรมเอนทาลปีของคุณด้านล่าง:

โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/variacao-entalpia-solucao.htm