เธ กฎแห่งความเร็วของปฏิกิริยา เกี่ยวข้องกับความเร็วของการเปลี่ยนแปลงทางเคมีกับความเข้มข้นของสารทำปฏิกิริยาในปริมาณของสสาร (โมล/ลิตร) ซึ่งสามารถระบุได้ดังนี้

ตัวอย่างเช่น พิจารณาปฏิกิริยาทั่วไปต่อไปนี้:
aA + bB → cC + dD
สมมุติว่าเราเพิ่มความเข้มข้นของสารตั้งต้น A และ B จะเกิดอะไรขึ้นกับความเร็วของปฏิกิริยา? เนื่องจากปริมาณของอนุภาคสารตั้งต้นจะเพิ่มขึ้นในพื้นที่เดียวกัน จะเกิดการชนกันระหว่างอนุภาคเหล่านี้อย่างมีประสิทธิภาพมากขึ้น ซึ่งจะส่งผลให้อัตราการพัฒนาปฏิกิริยาเพิ่มขึ้น ซึ่งหมายความว่าจะเพิ่มความเร็วของคุณ
ดังนั้นอัตราการเกิดปฏิกิริยาจึงเป็นสัดส่วนโดยตรงกับความเข้มข้นของสารตั้งต้น แต่ก็ขึ้นอยู่กับอุณหภูมิด้วย ดังนั้นเราจึงมีสมการทางคณิตศาสตร์ต่อไปนี้ซึ่งแสดงถึงกฎของความเร็วปฏิกิริยา:

เกี่ยวกับอะไร:
v = ความเร็วปฏิกิริยา;
k = ค่าคงที่ที่ขึ้นอยู่กับค่าอุณหภูมิเท่านั้น
α และ β = เลขชี้กำลังกำหนดจากการทดลอง
เมื่อปฏิกิริยาเป็นพื้นฐาน กล่าวคือ เกิดขึ้นในขั้นตอนเดียว เลขชี้กำลังจะเท่ากับสัมประสิทธิ์ของสมการเคมีที่สมดุลพอดี: วี = เค [THE]. [B]บี. อย่างไรก็ตาม ในกรณีอื่น ต้องกำหนดศักยภาพที่เหมาะสมซึ่งต้องเพิ่มความเข้มข้นของสารทำปฏิกิริยาแต่ละชนิดในการทดลอง
กฎของความเร็วของปฏิกิริยามีหลายชื่อ นี่คือบางส่วน: กฎของการกระทำจำนวนมาก สมการความรวดเร็ว กฎการเคลื่อนที่ของปฏิกิริยา และกฎของ Guldberg-Waage
พิจารณาตัวอย่างวิธีการใช้กฎหมายนี้:
พิจารณาปฏิกิริยาเบื้องต้นต่อไปนี้:
2 HCl (ช) → ฮ2(ก.) + Cl2(ก.)
ก) เขียนสมการความเร็วของปฏิกิริยานี้
b) จากการทดลอง ความเร็วของปฏิกิริยาการสลายตัวของก๊าซไฮโดรเจนคลอไรด์และความเข้มข้นของสารทำปฏิกิริยานี้ ที่อุณหภูมิคงที่ 25 °C ถูกบันทึกไว้ในตารางด้านล่าง:
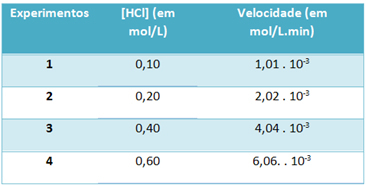
จากสิ่งนี้ ให้หาค่าคงที่ความเร็วลักษณะเฉพาะของปฏิกิริยาที่อุณหภูมิดังกล่าว
ความละเอียด:
ก) วี = เค [HCl]2
ข) วี = เค [HCl]2
เค = __วี___
[HCl]2
k = 1,01. 10-3 โมล หลี่-1. นาที-1
0.01 โมล หลี่-1
k = 1.01. 10-1 นาที-1
ในการแก้ตัวอักษร "b" คุณสามารถใช้ข้อมูลของการทดลองใดๆ ที่ค่าที่ได้จะเหมือนกัน
แต่ถ้าปฏิกิริยาไม่ใช่ระดับประถมศึกษาล่ะ? จะเป็นไปได้อย่างไรที่จะแก้ไขคำถามเช่นนี้ในปฏิกิริยาที่ไม่เกี่ยวกับพื้นฐาน? หากต้องการทราบวิธีการ อ่านกฎความเร็วสำหรับปฏิกิริยาที่ไม่ใช่องค์ประกอบ
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm

