Malus และ Huygens สังเกตเห็นแสงโพลาไรซ์ครั้งแรกในปี 1808 เมื่อสังเกตลำแสง ของแสงที่ลอดผ่านสปาร์ไอซ์แลนด์ ซึ่งเป็นผลึกใสของคาร์บอเนตหลายชนิด แคลเซียม.

ในปี ค.ศ. 1812 Jean-Baptiste Biot สังเกตว่าลำแสงโพลาไรซ์ถูกหมุนไปทางขวาในผลึกบางส่วนและในที่อื่น ๆ ไปทางซ้าย ข้อสังเกตสำคัญประการหนึ่งที่เขาทำคือไม่ใช่แค่สารที่เป็นของแข็ง หรือของเหลวบริสุทธิ์เท่านั้นที่ หมุนลำแสงโพลาไรซ์ แต่แม้กระทั่งสารละลายที่เป็นน้ำของสารอินทรีย์บางชนิดก็มีสิ่งนี้ ทรัพย์สิน สิ่งนี้ชี้ให้เห็นว่า ปรากฏการณ์ที่สังเกตได้นั้นเกิดจากโครงสร้างของโมเลกุลเอง
Biot ได้คิดค้นอุปกรณ์เพื่อสังเกตปรากฏการณ์การเบี่ยงเบนจากระนาบของแสงโพลาไรซ์ ซึ่งกลายเป็นที่รู้จักในชื่อ โพลาไรมิเตอร์. ในปี ค.ศ. 1842 Ventzke ได้รับการปรับปรุงให้สมบูรณ์แบบซึ่งดัดแปลงปริซึม Nicol ให้เข้ากับอุปกรณ์และหลายปีต่อมา Mitscherlich ได้แนะนำการใช้แสงสีเดียวในการสังเกต
แต่ในปี พ.ศ. 2389 เท่านั้นที่ปรากฏการณ์นี้ได้อธิบายผ่านการศึกษาของ หลุยส์ ปาสเตอร์ซึ่งเป็นลูกศิษย์ของ Biot ในระหว่างกระบวนการหมักน้ำองุ่นสำหรับการผลิตไวน์จะเกิดกรดสองชนิด: กรดทาร์ทาริกและกรดราซิมิก

แสตมป์ที่พิมพ์โดยสาธารณรัฐอัฟริกากลางแสดง Louis Pasteur (1822-1895) นักเคมีและจุลชีววิทยา ประมาณปี 1985*
กรดทั้งสองนี้มีสูตรโมเลกุลเหมือนกันและมีคุณสมบัติเหมือนกัน อย่างไรก็ตาม กรดทั้งสองนี้มีพฤติกรรมแตกต่างกันเมื่ออยู่ภายใต้ลำแสงโพลาไรซ์ เป็นที่ทราบกันดีอยู่แล้วว่า กรดทาร์ทาริกมีฤทธิ์ทางสายตาหมุนระนาบแสงโพลาไรซ์ไปทางขวา แล้วเกลือของ กรดราซิมิกไม่ทำงาน ภายใต้แสงโพลาไรซ์
ปาสเตอร์พบว่าในขณะที่กรดทาร์ทาริกประกอบด้วยโมเลกุลเพียงประเภทเดียว กรดราซิมิกมีสองประเภท การศึกษาเกลือที่ก่อตัวเป็นกรดทั้งสองอย่างถี่ถ้วน ปาสเตอร์พบว่าผลึกของกรดทาร์ทาริกนั้นไม่สมมาตรและเป็นผลึกของกรดราซิมิกด้วย อย่างไรก็ตาม คริสตัลบางส่วนด้านหลังมีใบหน้าที่แตกต่างกันไปทางด้านขวาและส่วนอื่นๆ ทางด้านซ้าย
เขาแยกผลึกเหล่านี้อย่างระมัดระวังและละลายแยกกันในน้ำ หลังจากทบทวนวิธีแก้ปัญหาเหล่านี้แล้ว เขาพบว่า ทั้งคู่มีการเคลื่อนไหวทางสายตา. ดังนั้น, กรด racemic ไม่บริสุทธิ์ แท้จริงแล้วประกอบด้วยกรดทาร์ทาริก dextrorotatory ครึ่งชนิด (ซึ่งเบี่ยงเบนไปจากแผน ของโพลาไรเซชันด้านขวา) และอีกครึ่งหนึ่งของกรดทาร์ทาริก levorotary (ซึ่งเปลี่ยนระนาบของโพลาไรเซชันไปที่ ซ้าย).เนื่องจากทั้งสองประเภทนี้ทำให้เกิดความคลาดเคลื่อนของค่าเดียวกัน แต่ในทิศทางตรงกันข้าม อีกประเภทหนึ่งจึงจบลงด้วยการยกเลิกอีกประเภทหนึ่ง และสารก็ไม่ทำงานทางสายตา
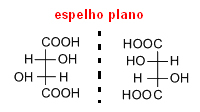
ดังนั้น เมื่อโมเลกุลมีคาร์บอนอสมมาตร เช่นในกรณีของกรดทาร์ทาริก จะทำให้เกิดเป็นสอง ไอโซเมอร์เชิงแสงที่มีสูตรโมเลกุลเดียวกัน แต่มีกิจกรรมทางแสงต่างกัน
* เครดิตรูปภาพ: rook76 และ Shutterstock.com
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/historia-isomeria-Optica.htm