เมื่อเราพูดถึง pHเราอ้างถึงศักยภาพของไฮโดรเจนไอออนของสารละลายนั่นคือปริมาณของไอออนบวกของไฮโดรเนียม (H+ หรือ H3โอ+) ซึ่งกระจายตัวอยู่ในตัวทำละลายของสารละลาย
ไอออนบวกของไฮโดรเนียมเป็นที่รู้จักกันดีเนื่องจากคำจำกัดความที่นักวิทยาศาสตร์เสนอให้ อาร์เฮเนียส สำหรับกรด นักวิทยาศาสตร์ท่านนี้อ้างว่า กรด เป็นสารทุกตัวที่มีความสามารถ แตกตัวเป็นไอออน และผลิตไฮโดรเนียมไอออนในตัวกลางที่เป็นน้ำ
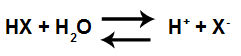
สมการไอออไนซ์ของกรด
ตัวย่อ pH ทำหน้าที่เป็นข้อมูลอ้างอิงสำหรับกำหนดระดับความเป็นกรดของตัวกลาง อย่างไรก็ตาม เป็นเวลานานนักเคมียังใช้ have pH เพื่อเป็นข้อมูลอ้างอิงเพื่อกำหนด นอกเหนือไปจากความเป็นกรด ว่าตัวกลางเป็นแบบเบสิกหรือเป็นกลาง
สิ่งนี้เป็นไปได้เพราะตอนนี้นักเคมีทราบว่าน้ำผ่านการแตกตัวเป็นไอออนในตัวเอง กล่าวคือ มันผลิตไฮโดรเนียม (H+) และไฮดรอกไซด์ (OH-). ดังนั้น สารละลายในน้ำไม่เคยมีแค่ไฮโดรเนียมหรือไฮดรอกไซด์เท่านั้น แต่ทั้งสองอย่าง ดังที่เราเห็นได้จากสมการต่อไปนี้:

สมการการทำให้เป็นอัตโนมัติของน้ำ
ค่าที่ใช้เป็นข้อมูลอ้างอิงสำหรับ pH
ค่าที่ใช้สำหรับ pH อ้างถึงค่าคงที่ไอออไนซ์ (Kw) ของน้ำที่อุณหภูมิ 25โอC ซึ่งเท่ากับ 10
-14. ที่อุณหภูมินี้ความเข้มข้นของไอออนของไฮโดรเนียมและไฮดรอกไซด์ที่เกิดจากน้ำจะเท่ากัน นั่นคือ 10-7 นางสาว.[ห้+]=[OH-]= 10-7
จากข้อมูลอ้างอิงนี้ ค่าที่ใช้สำหรับช่วง pH ตั้งแต่ 0 ถึง 14
สูตรคำนวณ pH
ก) การคำนวณจากความเข้มข้นเป็นโมล/ลิตรของไอออนบวกของไฮโดรเนียม
การคำนวณค่า pH สามารถทำได้โดยตรง ตราบใดที่เราทราบความเข้มข้นของไฮโดรเนียม ([H+]). ดู:
pH = -log[H+]
หรือ
10-pH = [H+]
b) การคำนวณจากความเข้มข้นของไฮดรอกไซด์แอนไอออน (OH-)
pOH = -log[OH-]
หรือ
10-poOH = [OH-]
หลังจากคำนวณค่า pOH แล้ว คุณต้องใช้ในนิพจน์ต่อไปนี้เพื่อกำหนดค่า pH
pH + pOH = 14
การตีความค่า pH
เมื่อทราบค่า pH เราสามารถระบุได้ว่าสารละลายดังกล่าวมีลักษณะเป็นกรด เบส หรือเป็นกลาง สำหรับสิ่งนี้ เพียงใช้ความสัมพันธ์แบบแผนผังต่อไปนี้:
สำหรับค่า pH ต่ำกว่า 7 = ตัวกลางที่เป็นกรด
สำหรับ pH ที่มีค่าเท่ากับ 7 = ตัวกลางเป็นกลาง
สำหรับค่า pH ที่สูงกว่า 7 = ตัวกลางพื้นฐาน
ตัวอย่าง
ตัวอย่างที่ 1: รู้ว่าความเข้มข้นของไอออนบวกของไฮโดรเนียมในสารละลายคือ 2.10-4 mol/L ค่า pH ของสารละลายนี้ควรเป็นเท่าใด
เพื่อหาค่า pH ของสารละลายจากความเข้มข้นของไฮโดรเนียม (H+), 2.10-4 mol/L เราต้องใช้นิพจน์ต่อไปนี้:
pH = -log[H+]
pH = -log[2.10-4 ]
pH = –(บันทึก 2 + บันทึก 10-4)
pH = -log2 - log10-4
pH = –log 2 – 4.log 10
pH = –0.3 + 4.(1)
pH = -0.3 + 4
pH = 3.7
ตัวอย่างที่ 2: สารละลายที่เกิดจากตัวถูกละลายบางชนิดมีความเข้มข้นของไฮดรอกไซด์ไอออนเท่ากับ10-11 นางสาว. จากความเข้มข้นนี้ เราสามารถพูดได้ว่า pH ของสารละลายนี้มีค่าเท่าใด
เพื่อกำหนดค่า pH ของสารละลายจากความเข้มข้นของไฮดรอกไซด์ 10-11 mol/L เราต้องดำเนินการดังต่อไปนี้:
1โอ ขั้นตอน: คำนวณค่า pOH
10-poOH = [OH-]
10-poOH = 10-11
เราต้องคูณนิพจน์ด้วย -1 เพราะ pOH เป็นค่าบวกที่ไม่ทราบค่าเสมอ
-poH = -11.(-1)
pOH = 11
2โอ ขั้นตอน: คำนวณค่า pH
pH + pOH = 14
pH + 11 = 14
pH = 14 - 11
pH = 3
By Me. Diogo Lopes Dias
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ph.htm
