อะตอมเป็นอนุภาคขนาดเล็กนับไม่ถ้วนที่ประกอบเป็นสสารทั้งหมดในจักรวาล เมื่อเวลาผ่านไป แนวความคิดที่ว่าโครงสร้างอะตอมจะเปลี่ยนไปอย่างไรตามการค้นพบใหม่ของนักวิทยาศาสตร์ คุณสามารถหาข้อมูลเพิ่มเติมเกี่ยวกับเรื่องนี้ได้ในข้อความวิวัฒนาการของแบบจำลองอะตอม.
แบบจำลองเป็นตัวแทนของความเป็นจริง (ไม่ใช่ความเป็นจริง) ดังนั้นแบบจำลองอะตอมจึงเป็นตัวแทนของ องค์ประกอบหลักของอะตอมและโครงสร้างของอะตอม และอธิบายพฤติกรรมทางกายภาพและเคมีบางประการของสสาร สิ่งนี้ทำได้เพราะยังไม่เป็นไปได้ที่มนุษย์จะมองเห็นอะตอมที่แยกได้แม้จะใช้อุลตร้าไมโครสโคป
เพื่อให้เข้าใจว่าอะตอมมีขนาดเล็กเพียงใด ดิ อนุภาคที่เล็กที่สุดที่มองเห็นได้ภายใต้กล้องจุลทรรศน์ธรรมดามีอะตอมมากกว่าหมื่นล้านอะตอม! อะตอมมีขนาดเล็กมากจนหากเราวางมันไว้คู่กัน เราก็จะไม่ถึง ความหนาของเส้นผม
แผนที่ความคิด: Atom
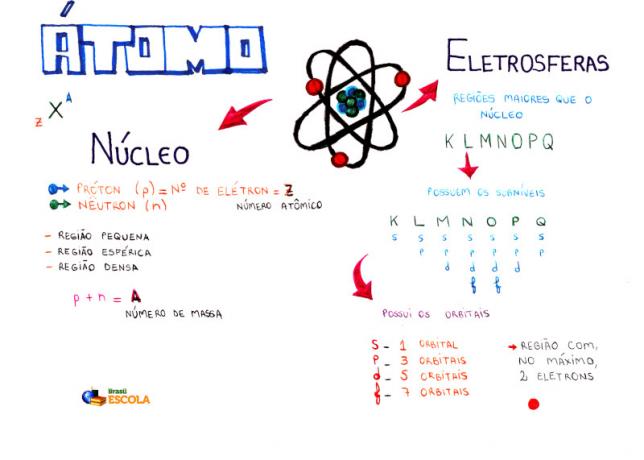
* ในการดาวน์โหลดแผนที่ความคิดในรูปแบบ PDF คลิกที่นี่!
ในบรรดาแบบจำลองอะตอม แบบจำลองที่ใช้มากที่สุดในโรงเรียนมัธยมศึกษาตอนปลายเพื่อทำความเข้าใจโครงสร้างของอะตอมและคุณสมบัติของอะตอมคือแบบจำลองรัทเธอร์ฟอร์ด-บอร์ ตามแบบจำลองนี้ โครงสร้างของอะตอมประกอบด้วยสองส่วนหลัก: แกน และ อิเล็กโทรสเฟียร์.

สองส่วนหลักของโครงสร้างของอะตอม - อิเล็กโตรสเฟียร์และนิวเคลียส
* แกนหลัก: ประกอบขึ้นเป็นส่วนกลางของอะตอม มีขนาดกะทัดรัด มวลและหนาแน่นมาก นอกจากจะก่อตัวขึ้นจากอนุภาคที่มีมวลมากกว่า ซึ่งก็คือโปรตอนและนิวตรอน

ภาพประกอบของโปรตอนและนิวตรอนที่ประกอบขึ้นเป็นนิวเคลียสของอะตอม
- โปรตอน: เป็นอนุภาคที่มีประจุไฟฟ้าเป็นบวก (ประจุสัมพัทธ์ = +1; ประจุเป็นคูลอมบ์ (C) = +1.602 10-19) และมวลสัมพัทธ์เท่ากับ 1
ข้อเท็จจริงที่ว่าโปรตอนสร้างนิวเคลียสและทำให้มีประจุบวกโดยรวมนั้นถูกค้นพบโดย ยูเกน โกลด์สตีน, ในปี พ.ศ. 2429 ผ่านการดัดแปลงหลอดแก้วของครูกส์และการทดลองบางอย่าง เขาเห็นว่าภายใต้แรงดันไฟฟ้าที่สูงมาก การปล่อยก๊าซก็ปรากฏขึ้น (รังสีแอโนด - เศษอะตอมของก๊าซที่อยู่ในหลอดไฟและอิเล็กตรอนของพวกมันถูกปล่อยโดยการปล่อยไฟฟ้า) โดยการวางสนามไฟฟ้าหรือสนามแม่เหล็กนอกหลอดไฟ รังสีเหล่านี้จะเบี่ยงเบนไปทางขั้วลบ นี่หมายความว่ามีอนุภาคย่อยของอะตอมที่เป็นบวกซึ่งเรียกว่าโปรตอน
ต่อมา เออร์เนสต์ รัทเทอร์ฟอร์ด (1871-1937) ทำการทดลองที่อธิบายไว้ในข้อความ อะตอมของรัทเธอร์ฟอร์ดซึ่งทำให้เขาค้นพบตำแหน่งของโปรตอน: ในนิวเคลียส
- นิวตรอน: พวกมันเป็นอนุภาคที่มีมวลเท่ากับโปรตอน (1) แต่ตามที่ชื่อบอกไว้ พวกมันเป็นกลาง นั่นคือ พวกมันไม่มีประจุไฟฟ้า
นิวตรอนถูกค้นพบในปี 1932 โดย เจมส์ แชดวิก (พ.ศ. 2434-2517) ผู้ตระหนักว่านิวเคลียสของเบริลเลียมกัมมันตภาพรังสีปล่อยอนุภาคเป็นกลางซึ่งมีมวลประมาณเท่ากับมวลของโปรตอน
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
เส้นผ่านศูนย์กลางของนิวเคลียสขึ้นอยู่กับปริมาณโปรตอนและนิวตรอนที่อะตอมมี แต่โดยเฉลี่ยแล้วจะอยู่ที่ประมาณ 10-14 เดือนและ 10-15 เมตร
นิวเคลียสของอะตอมรวมมวลทั้งหมดของอะตอมเป็นส่วนประกอบที่เล็กมาก: ทั้งโปรตอนและนิวตรอนนั้นเล็กกว่าอะตอมทั้งหมดประมาณ 100,000 เท่า! โดยการเปรียบเทียบ ลองนึกภาพว่าเราขยายนิวเคลียสของอะตอมของธาตุไฮโดรเจน (ซึ่งมีเพียง โปรตอน) กับขนาดของลูกเทนนิส อิเล็กตรอนที่ใกล้ที่สุดจะอยู่ห่างจาก. ประมาณ 3 กิโลเมตร ระยะทาง! แม้ว่าอะตอมจะถูกขยายให้สูงถึงความสูงของอาคาร 14 ชั้น แกนกลางของมันก็จะมีขนาดเท่าเม็ดเกลือบนชั้นที่เจ็ด มันเป็นเรื่องที่น่าทึ่งจริงๆ คุณว่าไหม!
* อิเล็กโทรสเฟียร์: คือ บริเวณที่อิเล็กตรอนหมุนรอบนิวเคลียส. แม้จะเป็นบริเวณที่มีปริมาตรมากกว่านิวเคลียสมาก แต่ก็เกือบจะว่างเปล่า เนื่องจากอิเล็กตรอนแต่ละตัวมีขนาดเล็กกว่า 1 โปรตอน 1,836 เท่า (หรือมากกว่า 1 นิวตรอน) นั่นเป็นเหตุผลที่มวลของอะตอมเกือบทั้งหมดอยู่ในนิวเคลียส อิเล็กตรอนเป็นอนุภาคที่มีประจุไฟฟ้าเป็นลบ (-1)
อิเล็กตรอนถูกค้นพบในปี พ.ศ. 2440 โดย โจเซฟ จอห์น ทอมสัน (2399-2483) ผู้สร้าง แบบจำลองอะตอมของทอมสัน. การทดลองของ Thomson สามารถดูรายละเอียดได้ในข้อความ การทดลองของทอมสันกับการปล่อยไฟฟ้าแต่ในระยะสั้นเขาใช้หลอด Crookes ดังกล่าวและตระหนักว่ารังสีแคโทดอยู่เสมอ ดึงดูดโดยขั้วบวกซึ่งพิสูจน์ว่าอะตอมมีอนุภาคลบซึ่งเรียกว่า อิเล็กตรอน
อิเล็กตรอนหมุนรอบนิวเคลียสหลายพันล้านครั้งต่อวินาที ทำให้เกิดรูปร่างของอะตอมและทำให้มีลักษณะเหมือนของแข็ง
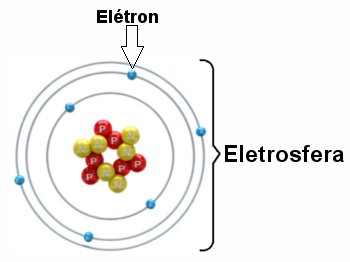
ภาพประกอบของอิเล็กโตรสเฟียร์ที่มีชั้นอิเล็กทรอนิกส์สามชั้นและอิเล็กตรอนหมุนรอบนิวเคลียส
โดยสังเขป เราสามารถสร้างตารางเพื่อแยกความแตกต่างของอนุภาคย่อยของอะตอมหลักสามตัวที่เป็นส่วนหนึ่งของโครงสร้างของอะตอม:

มวลและประจุไฟฟ้าของอนุภาคหลักสามอะตอม - โปรตอน นิวตรอน และอิเล็กตรอน
อะตอมขององค์ประกอบทางเคมีทั้งหมดประกอบด้วยอนุภาคย่อยทั้งสามนี้ องค์ประกอบทางเคมีที่แตกต่างจากองค์ประกอบอื่นคือปริมาณที่อนุภาคเหล่านี้ปรากฏขึ้น โดยเฉพาะอย่างยิ่งปริมาณของโปรตอนในนิวเคลียสซึ่งเรียกว่าเลขอะตอม ให้ศึกษาเกี่ยวกับเรื่องนี้ผ่านข้อความ องค์ประกอบทางเคมี.
* แผนที่ความคิดโดยฉัน Diogo Lopes
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
เคมี
การจำแนกสสาร น้ำ ก๊าซไฮโดรไซยานิก คาร์บอนไดออกไซด์ แอมโมเนีย ไฮโดรเจน ฮีเลียม สาร อย่างง่าย, สารผสม, สารผสม, เฟสของของผสม, ของผสมที่เป็นเนื้อเดียวกัน, ของผสม ต่างกัน



