Naučte sa aplikovať prvý termodynamický zákon v rôznych situáciách, riešte úlohy a otestujte si svoje vedomosti na vyriešených a vysvetlených cvičeniach.
Otázka 1
Prvý zákon termodynamiky hovorí, že:
a) Energia nemôže byť vytvorená alebo zničená, ale môže byť premenená z jednej formy na druhú.
b) Energia sa vždy zachováva, ale nemôže byť premenená z jednej formy na druhú.
c) Energia môže byť vytvorená alebo zničená, ale nemôže byť premenená z jednej formy na druhú.
d) Energiu nemožno zachovať, ale možno ju premeniť z jednej formy na druhú.
Prvý zákon termodynamiky je princíp zachovania energie, teda v systéme zatvorené, množstvo energie zostáva konštantné a môže sa premeniť iba z jednej formy na druhú. iné.
otázka 2
Predpokladajme uzavretý systém, ktorý prijíma 100 J tepla a zároveň vykonáva 50 J práce. Aká je zmena vnútornej energie systému?
a) -50 J
b) 0 J
c) 50 J
d) 100 J
e) 150 J
Kontrola značiek:
Prijaté teplo je kladné Q > 0.
Vykonaná práca je kladná W > 0.
Podľa prvého zákona máme:
otázka 3
Ideálny plynový systém si s vonkajším prostredím vymieňa 500 joulov tepla. Za predpokladu, že tento proces je izometrické chladenie, určite prácu a vnútornú energiu.
a) 500 J a 0 J
b) - 500 a 0 J
c) 0 J a 500 J
d) 0 J a - 500 J
e) -500 J a 500 J
Keďže proces je izometrický, nedochádza k žiadnej zmene objemu, takže práca je nulová.
Podľa prvého zákona termodynamiky:
Keďže ide o chladenie, systém stráca teplo, preto:
otázka 4
8 mólov ideálneho plynu v systéme piest-valec sa stlačí vykonaním 1000 J práce. Počas procesu sa do vonkajšieho prostredia stratí 400 J tepla. Jeho vnútorná energia a zmena jeho teploty sú rovnaké
Dané: R = 8,31 J/mol. K
a) - 1400 J a približná odchýlka 6 K
b) 600 J a približná odchýlka 6 K
c) 600 J a približná zmena 14 K
d) - 1400 J a približná odchýlka 14 K
vnútornej energie
Keď systém prijíma prácu, jeho znamienko je záporné, rovnako ako teplo, ktoré sa pri tomto procese stráca.
Prvý zákon termodynamiky znie:
Nahradením hodnôt dostaneme:
R = 8,31 J/mol K
Teplota
Podľa Jouleovho zákona máme:
otázka 5
Dokonalý plyn sa stlačí a vykoná 500 J práce. Na konci tejto transformácie sa vnútorná energia systému zmenila o 200 J menej ako na začiatku. Množstvo tepla vymeneného plynom bolo
a) - 700 J
b) - 300 J
c) 300 J
d) 0J
e) 700 J
Keďže práca bola prijatá, teda odolná práca, jej znamienko je záporné.
Nahradením hodnôt do rovnice prvého zákona termodynamiky:
otázka 6
(CEDERJ 2021) Vo fáze cyklu, ktorú vykonáva ideálny plyn v klimatizácii, sa tlak plynu zvyšuje, pričom sa jeho objem udržiava konštantný. V tejto fáze cyklu je práca W vykonaná plynom, množstvo ním absorbovaného tepla Q a zmena ΔT jeho teploty:
a) W < 0, Q < 0 a ΔT < 0
b) W = 0, Q > 0 a AT > 0
c) W = 0, Q = 0 a AT = 0
d) W > 0, Q > 0 a ΔT > 0
údaje:
Tlak P sa zvyšuje;
Objem zostáva konštantný;
Práca
Keďže objem je konštantný, práca W sa rovná nule.
Prvý zákon termodynamiky znie takto:
Keďže teplo je pozitívne, zmena vnútornej energie bude tiež pozitívna.
Teplo
Keďže sa teplo absorbuje, je to pozitívne.
Teplota
Podľa zákona o plyne:
Kde,
n je počet mólov
R je univerzálna plynová konštanta
Teplota teda závisí iba od tlaku, pretože objem je konštantný a je kladný.
otázka 7
(UNICENTRO 2018) Podľa prvého zákona termodynamiky je zmena vnútornej energie systému ΔU daný rozdielom medzi teplom vymeneným s vonkajším prostredím Q a prácou W vykonanou v procese termodynamické. Ak vezmeme do úvahy túto informáciu, ak sa monatomický plyn rozpína tak, že má vždy rovnakú teplotu, túto transformáciu možno znázorniť rovnicou
a) ΔU + W = 0
b) ΔU − W =0
c) Q − W = 0
d) Q + AU = 0
Izotermický proces prebieha bez zmeny teploty.
Energia súvisí s teplotou:
Kde n je počet mólov a R je univerzálna plynová konštanta. Pretože n a R sú konštantné, existuje iba zmena teploty a
Prvý zákon termodynamiky znie takto:
otázka 8
(URCA 2016) Podľa prvého zákona termodynamiky, ak počas izotermického procesu prechádzajúceho ideálnym plynom s pevnou hmotnosťou, plyn uvoľňuje množstvo tepla, ktorého veľkosť je 50 cal, potom zmena vnútornej energie a práca vykonaná plynom v tomto procese sú, v tomto poradí:
a) 0 a 50 kal.
b) 50 cal a 0.
c) 0 a 0.
d) 50 cal a -50 cal.
e) 0 a -50 kal.
Zmena vnútornej energie priamo súvisí so zmenou teploty. Keďže proces je izotermický, nedochádza k žiadnym zmenám teploty .
Z prvého zákona termodynamiky:
Keďže sa uvoľňuje teplo, jeho znamienko je záporné.
otázka 9
(UFRN 2012) Biomasa je jedným z hlavných zdrojov obnoviteľnej energie, a preto sú stroje, ktoré ju využívajú ako palivo na výrobu energie, dôležité z hľadiska životného prostredia. Veľmi častým príkladom je využitie biomasy na pohon parnej turbíny na generovanie práce. Obrázok na boku schematicky znázorňuje zjednodušenú termoelektráreň.
V tejto termoelektrárni vzniká pri spaľovaní biomasy v peci teplo, ktoré ohrieva vodu v kotle a vytvára vysokotlakovú paru. Para je zas vedená potrubím do turbíny, ktorá pri jej pôsobení začne otáčať lopatky.
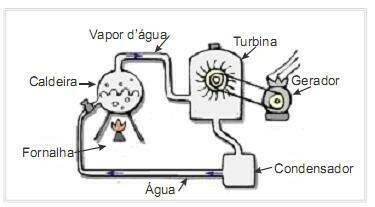
Tepelné straty v dôsledku teplotných rozdielov medzi časťami tohto tepelného stroja a prostredím predpokladajte ako zanedbateľné. V tejto súvislosti kolísanie vnútornej energie kotlovej vody
a) je väčší ako súčet tepla, ktoré mu bolo dodané spaľovaním biomasy a práce vykonanej na turbíne.
b) sa rovná súčtu tepla, ktoré mu bolo dodané spaľovaním biomasy s prácou vykonanou na turbíne.
c) sa rovná rozdielu medzi teplom dodaným jej spaľovaním biomasy a prácou vykonanou na turbíne.
d) je väčší ako rozdiel medzi teplom dodaným jej spaľovaním biomasy a prácou vykonanou na turbíne.
Voda v kotli prijíma energiu vo forme tepla zo spaľovania paliva a uvoľňuje energiu vo forme práce vykonanej na turbíne.
otázka 10
(UECE 2021) Pokiaľ ide o vlastnosti plynov, venujte pozornosť nasledujúcim vyhláseniam:
i. Pre ideálny plyn je vnútorná energia iba funkciou tlaku.
II. Teplo absorbované plynom pri zmene jeho skupenstva je nezávislé od procesu.
III. Vnútorná energia ideálneho plynu je iba funkciou teploty a je nezávislá od procesu.
IV. Pri izotermickej expanzii ideálneho plynu sa práca, ktorú vykoná, rovná absorbovanému teplu.
Správne je to, čo je uvedené iba v
a) I a II.
b) III a IV.
c) I a IV.
d) II a III.
III. SPRÁVNE Vnútorná energia ideálneho plynu je iba funkciou teploty a je nezávislá od procesu.
Zmena vnútornej energie priamo súvisí so zmenou teploty.
Kde n je počet mólov a R je ideálna plynová konštanta, keďže sú konštanty, iba teplota určuje vnútornú energiu plynu.
IV. SPRÁVNE Pri izotermickej expanzii ideálneho plynu sa práca, ktorú vykoná, rovná absorbovanému teplu.
Keďže je izotermický, nedochádza k zmene teploty, takže zmena vnútornej energie je nulová. Podľa prvého zákona termodynamiky:
Zistite viac pomocou:
- Prvý zákon termodynamiky
- Termodynamika: zákony, pojmy, vzorce a cvičenia
- Cvičenia z termodynamiky
- plynárenský zákon
ASTH, Rafael. Cvičenia prvého zákona termodynamiky.All Matter, [n.d.]. Dostupné v: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Prístup na:
Pozri tiež
- Cvičenia z termodynamiky
- Termodynamika
- adiabatická transformácia
- Cvičenia z termochémie
- Prvý zákon termodynamiky
- Prírodné vedy a ich technológie: Enem
- Termálna energia
- Druhý zákon termodynamiky

