Citlivé teplo alebo citlivé špecifické teplo je fyzikálna veličina, ktorá súvisí s kolísaním teploty tela.
Príklad: Ohrev kovovej tyče
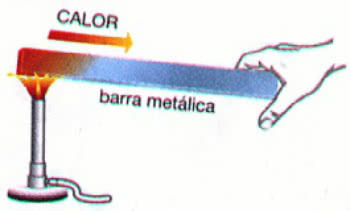
Vo vyššie uvedenom príklade sa teplo šíri cez tepelné vedenie. Výsledkom tohto procesu je zvýšenie teploty materiálu, jeho fyzikálny stav však zostáva rovnaký (tuhý).
Vzorec
Na výpočet citeľného tepla sa používa tento vzorec:
Q = m. ç. Δθ
Q: množstvo citeľného tepla (vápno alebo J)
m: telesná hmotnosť (g alebo kg)
ç: špecifické teplo látky (kal / g ° C alebo J / Kg ° C)
Δθ: kolísanie teploty (° C alebo K)
Poznámka: Na výpočet citeľného tepla musíme poznať špecifické teplo, ktoré sa líši v každej látke.
Prečítajte si viac na: Špecifické teplo.
Citlivé teplo a latentné teplo
Na latentné teplo (L) sa fyzikálny stav látky upraví, zatiaľ čo v citeľnom teple zostáva rovnaká.
Ďalším rozdielom medzi týmito dvoma teplotami je teplota. To znamená, že latentné teplo nezávisí od teploty tela, zatiaľ čo ho citeľné teplo považuje za potrebné.
Príkladom latentného tepla je topenie kocky ľadu alebo odparovanie vody. V obidvoch prípadoch zostáva teplota v dvoch fyzikálnych stavoch rovnaká.
Na výpočet latentného tepla použite nasledujúci vzorec:
Q = m. Ľ
Kde,
Q: množstvo tepla (vápno alebo J)
m: hmotnosť (g alebo kg)
Ľ: latentné teplo (kal / g alebo J / kg)
Prečítajte si tiež:
- Teplo a teplota
- Kalorimetria
- Tepelná rovnováha
- Tepelná kapacita
- Fyzikálne vzorce
Cvičenia na prijímacie skúšky so spätnou väzbou
1. (Mackenzie) Tepelný zdroj dodáva teplo nepretržite rýchlosťou 150 kal / s na dané množstvo vody. Ak sa teplota vody zvýši z 20 ° C na 60 ° C za 4 minúty, pričom špecifická citlivosť vody na vodu je 1,0 kcal / g ° C, možno vyvodiť záver, že hmotnosť ohriatej vody v gramoch je:
a) 500
b) 600
c) 700
d) 800
e) 900
Alternatívne a
2. (UFSM-RS) sa umiestni 400 g telo a citlivé špecifické teplo 0,20 kal / g ° C pri teplote 10 ° C v tepelnom kontakte s ďalšími 200 g tela a citlivým špecifickým teplom 0,10 kal / g ° C, pri teplote 60 ° C. Konečná teplota, keď sa vytvorí tepelná rovnováha medzi týmito dvoma telesami, bude:
a) 14 ° C
b) 15 ° C
c) 20 ° C
d) 30 ° C
e) 40 ° C
Alternatíva c
3. (UFPR) Počas zatmenia došlo v jednom z miest totálnej zóny Criciúma - SC k poklesu teploty o 8,0 ° C. (Nulové hodiny - 4. apríla 1994)
S vedomím, že citlivé špecifické teplo vody je 1,0 kcal / g ° C, je množstvo tepla uvoľneného 1000 g vody pri znížení jej teploty z vápna z 8,0 ° C na:
a) 8,0
b) 125
c) 4 000
d) 8000
e) 64 000
Alternatívne



