THE hydrolýza solí medzi silnými kyselinami a zásadami nastáva, keď katión v soli neinteraguje s aniónom vo vode a anión v soli neinteraguje s katiónom vo vode. Hydrolýza medzi katiónmi a aniónmi soli a vody nastáva, iba ak je vytvoreným produktom slabá kyselina, slabá zásada alebo oboje. Postupne pochopte hydrolýzu solí medzi silnými kyselinami a silnými zásadami:
a) Krok 1: ionizácia vody
Voda je látka, ktorá má schopnosť trpieť autoionizácia, to znamená, že produkuje hydróniový katión (H.+) a hydroxidový anión (OH.)-) z jeho štruktúry.
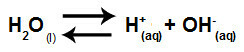
Rovnica predstavujúca samoionizáciu vody
b) Krok 2: Disociácia soli
Keď sa soľ pridá do vody, prechádza procesom disociácie. Pretože soľ je iónová zlúčenina, vo vode sa jej katióny a anióny uvoľňujú do média, ako je uvedené v rovnici uvedenej nižšie:
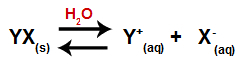
Rovnica predstavujúca disociáciu ktorejkoľvek soli
c) Krok 3: Hydrolýza solí silných kyselín a zásad
Pre silnú kyselinu: keď sa anión soli skombinoval s H+ vody za vzniku HCl, HBr, HI alebo inej kyseliny, v ktorej je odpočet počtu kyslíkov od počtu vodíkov rovný alebo väčší ako 2, budeme mať
silná kyselina. Kombinácia medzi spomínanými iónmi preto nenastáva.Pre silný základ: keď sa katión soli patriacej do rodiny IA (alkalické kovy) alebo IIA (kovy alkalických zemín iné ako horčík) kombinuje s OH- vody, vytvorí a silný základ. Kombinácia medzi spomínanými iónmi preto nenastáva.
Keď ióny soli neinteragujú s iónmi vody, máme nasledujúcu rovnicu:
Teraz neprestávajte... Po reklame je toho viac;)
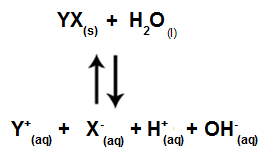
Rovnica ukazujúca všetky ióny prítomné v roztoku
Stručne povedané, keďže soľné ióny neinteragujú s vodnými iónmi, nepodporujú soľné ióny v konečnom roztoku žiadnu zmenu. Môžeme teda napísať rovnicu hydrolýzy solí medzi silnými kyselinami a silnými zásadami len pomocou rovnice ionizácie vody.
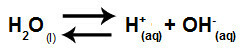
Rovnica predstavujúca hydrolýzu silných kyselín a zásad
d) Príklad hydrolýzy solí medzi silnými kyselinami a zásadami
Keď pridáme chlorečnan draselný do vody (KClO3), soľ disociuje a uvoľňuje draselný katión (K.+) a chlorečnanový anión (ClO3-) v strede.
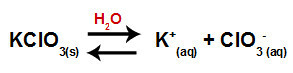
Disociačná rovnica pre chlorečnan draselný
Je dôležité mať na pamäti, že voda prechádza samoionizáciou a dodáva médiu hydróniový katión (H+) a hydroxidový anión (OH.)-). Teraz musíme vyhodnotiť interakciu medzi iónmi soli a vody.
Keď sa H+ interaguje s ClO3-, vytvára kyselinu chloristú (HclO3). Pretože odčítanie počtu kyslíkov od počtu ionizovateľných vodíkov v kyseline chloristej je 2, je silné. Preto nedochádza k interakcii medzi iónmi.
Keď katión K.+ interaguje s OH aniónom-, dochádza k vytvoreniu silnej bázy, pretože draslík je alkalický kov. Preto nedochádza k interakcii medzi iónmi.
Rovnica, ktorá predstavuje hydrolýzu solí medzi silnými kyselinami a zásadami z rozpustenia chlorečnanu draselného vo vode, je:
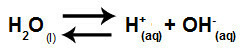
Chemická rovnica hydrolýzy chlorečnanu draselného
Podľa mňa. Diogo Lopes Dias
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
DNI, Diogo Lopes. „Hydrolýza soľného roztoku medzi silnými kyselinami a silnými zásadami“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm. Prístup k 28. júnu 2021.
Chémia

Otestujte si svoje vedomosti a dozviete sa viac pomocou tohto zoznamu vyriešených cvičení o chemických rovnováhách. Prostredníctvom tohto materiálu budete schopní lepšie pochopiť, ako pracovať s rovnovážnymi konštantami (Kp, Kc a Ki), rovnovážnym posunom, pH a pOH, ako aj s rovnovážnymi stavmi v takzvaných tlmivých roztokoch.