Existuje odvetvie vedy, ktoré študuje rýchlosť chemických reakcií a faktory, ktoré ju ovplyvňujú, nazýva sa chemická kinetika. Chemické reakcie možno definovať ako súbor javov, v ktorých dve alebo viac látok navzájom reagujú a vedú k vzniku rôznych zlúčenín. Chemická rovnica je grafické znázornenie chemickej reakcie, kde sa reaktanty objavujú v prvom člene a produkty v druhom.
A + B  C + D
C + D
Reagenčné produkty
Znalosti a štúdium reakcií sú z priemyselného hľadiska veľmi dôležité, ale súvisia aj s našim každodenným životom.
Rýchlosť reakcie je to, ako rýchlo sa reaktanty spotrebujú alebo ako rýchlo sa tvoria produkty. Horenie sviečky a tvorba hrdze sú príkladmi pomalých reakcií. V dynamite je rozklad nitroglycerínu rýchlou reakciou.
Rýchlosti chemických reakcií sú určené empirickými zákonmi, ktoré sa nazývajú zákony rýchlosť, odvodená z účinku koncentrácie reaktantov a produktov na rýchlosť reakcia.
Chemické reakcie prebiehajú rôznymi rýchlosťami a je možné ich meniť, pretože okrem koncentrácia reaktantov a produktov, reakčné rýchlosti závisia aj od ďalších faktorov Páči sa mi to:
Koncentrácia činidla: čím vyššia je koncentrácia reaktantov, tým rýchlejšia bude reakcia. Aby mohla reakcia prebehnúť medzi dvoma alebo viacerými látkami, je potrebné, aby sa molekuly zrazili, takže dôjde k pretrhnutiu väzieb s následným vytvorením nových. Počet zrážok bude závisieť od koncentrácií A a B. Pozri obrázok:
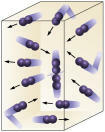
Molekuly sa zrážajú častejšie, ak
zvyšujeme počet reagujúcich molekúl.
Teraz neprestávajte... Po reklame je toho viac;)
Je ľahké vidieť, že v dôsledku vyššej koncentrácie dôjde k zvýšeniu kolízií medzi molekulami.
kontaktná plocha: zväčšenie kontaktného povrchu zvyšuje rýchlosť reakcie. Príkladom je, keď rozpustíme rozdrvenú tabletu Sonrisalu a tá sa rozpustí rýchlejšie než keby to bolo celé, stane sa to preto, lebo zväčšujeme kontaktnú plochu, ktorá reaguje s Voda.
Tlak: keď zvýšite tlak plynného systému, rýchlosť reakcie sa zvýši.
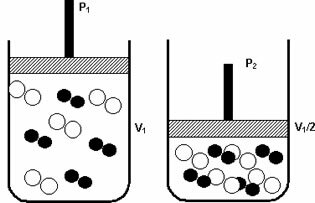
Zvýšenie tlaku z P1 na P2 znížilo objem z V1 na V1 / 2 a urýchlilo reakciu v dôsledku prístupu molekúl.
Obrázok vyššie slúži ako príklad, pretože so zmenšením objemu v druhej nádobe dôjde k zvýšeniu hodnoty tlak zosilňujúci zrážky molekúl a v dôsledku toho zvýšenie rýchlosti reakcia.
Teplota: keď sa zvýši teplota systému, dôjde tiež k zvýšeniu reakčnej rýchlosti. Zvýšenie teploty znamená zvýšenie kinetickej energie molekúl. V každodennom živote môžeme tento faktor pozorovať pri varení a zvyšujeme plameň sporáka tak, aby jedlo rýchlejšie dosiahlo stupeň varenia.
Katalyzátory: Katalyzátory sú látky, ktoré urýchľujú mechanizmus bez toho, aby prešli trvalou zmenou, to znamená, že sa počas reakcie nespotrebujú. Katalyzátory umožňujú, aby sa reakcia uberala alternatívnou cestou, ktorá si vyžaduje menej aktivačnej energie, čo spôsobuje rýchlejší priebeh reakcie. Je dôležité mať na pamäti, že katalyzátor urýchľuje reakciu, ale nezvyšuje výťažok, to znamená, že produkuje rovnaké množstvo produktu, ale za kratšiu dobu.
Líria Alves
Vyštudoval chémiu
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
SOUZA, Líria Alves de. "Chemická kinetika"; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm. Prístup k 27. júnu 2021.



