По-голямата част от материалите, намиращи се в природата, в нашето общество и в телата ни, не са чисти вещества, а всъщност смеси от две или повече вещества.
Въпреки че в повечето случаи се отнасяме към минералната вода само като „вода“, в действителност тя не съдържа само чистото вещество H2О, защото е резултат от процес, при който дъждовната вода прониква в почвата и преминава през различни скали.
И така, както подсказва името му, освен водата, той има и няколко разтворени минерала. Ако сте любопитни да проверите етикета на която и да е минерална вода, ще видите, че тя има в състава си химия стронциеви сулфати, калций, натрий, калий, натриев бикарбонат, натриев флуорид, сред други.
Карта на ума: Смеси
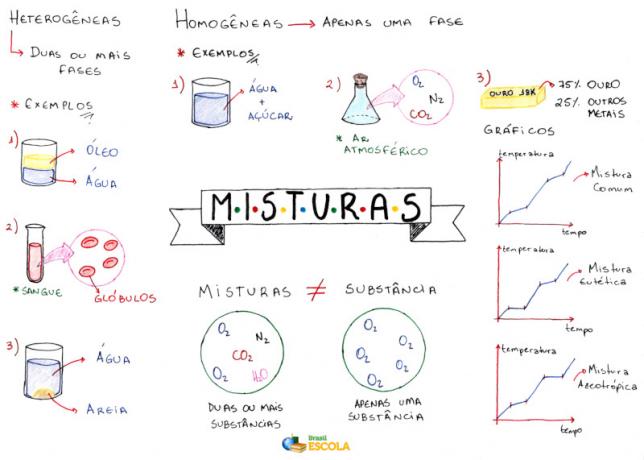
* За да изтеглите мисловната карта в PDF, Натисни тук!
Как е възможно да се разграничи вещество от смес?
Показаната по-долу дестилирана вода е чисто вещество, което съдържа само Н2O:

Дестилирана вода, използвана в лаборатория
Визуално изглежда точно като смес от вода и сол; те обаче могат да бъдат разграничени от дефиницията на смес. Виж:
→ Смеси са материали, чиито физични свойства не са постоянни, а варират при определена температура и налягане.
Така че, просто измерете физични свойства, като точки на топене и кипене и плътност. Ако те са постоянни и добре дефинирани, това е a чисто вещество (в случая на дестилирана вода при 4 ° C плътността му е 1,0 g / cm3 и на морско ниво точките на топене и кипене са съответно 0 ° C и 100 ° C).
Ако обаче са представени вариации, това е смес. Ако загреете водно-солената смес, за да проверите точката на кипене, ще видите, че по време на преминаването от течно състояние в газ, температурата не остава постоянна, както при дестилираната вода, която остава на 100 ° C, докато цялата течност се обърне пара.
Сега има смеси че дори не е необходимо да се определят физическите им свойства, за да се знае, че те са смеси, просто погледнете, както е в случая със следната смес от вода и масло:

Смес, образувана от вода и масло
Това показва, че има различни видове смеси, които могат да бъдат класифицирани еднородни и хетерогенни. Вижте всеки един:
Хомогенни смеси:
Те са тези, които имат еднакъв външен вид, с една фаза (монофазни). Примери:
физиологичен разтвор (0,9 g натриев хлорид в 100 ml вода);
саламура (36 g соли като натриев хлорид, магнезиев хлорид, калиев йодат, анти-овлажнители и 100 ml вода);
хидратиран алкохол (етанол и вода);
въздух (78% азотен газ, 20% кислороден газ, 2% други газове и водни пари);
стомана (метална сплав, образувана от 98,5% желязо и 1,5% въглерод).

Физиологичен разтвор, стомана и формалдехид, примери за хомогенни смеси
Примерите по-горе показват това хомогенни смеси те могат да бъдат в твърдо, течно или газообразно състояние. Тези еднородни смеси се наричат решения и те не могат да бъдат разделени с физически методи, а само с химически техники. За да се отдели алкохолът от водата, например, е необходимо да се извърши процес на дестилация, защото а центрофуга или филтрация нямаше да стане.
Освен това е важно да се подчертае, че те трябва да бъдат хомогенен дори когато се гледа под ултрамикроскоп. За невъоръжено око млякото и кръвта например могат да изглеждат хомогенни, но под ултрамикроскопа виждаме, че всъщност те са разнородни. Вижте изображението на кръвта под ултрамикроскопа и отделните му фази, след като е поставена в ултрацентрифуга:
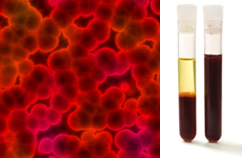
Микроскопско изображение и кръвни фази
Хетерогенни смеси:
Има ли тези, които имат повече от една фаза. Примери: вода и масло, вода и пясък, лед и вода, гранит, вода и желязо, неразтворена сол във вода и др.
Компонентите на хетерогенни смеси те се появяват, в повечето случаи, в различни физически състояния и могат да бъдат разделени чрез физически методи. Пример се получава, когато правим кафе и филтрираме твърдото вещество, отделяйки го от течността.
Но това не винаги се случва, както е показано в случая на масло и вода, които въпреки че са и двете течности, не се разтварят поради различни полярности на неговите молекули.
Психическа карта От майката Виктор Рикардо Ферейра
Учител по химия
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/tipos-misturas.htm
