НА константа на хидролизата (Kh) се отнася до a химичен баланс установени от хидролизата на сол (химическа реакция, включваща разтворима сол и вода).
Като константа на всяко друго равновесие, изразът на константа на хидролизата се конструира от продукта на концентрациите на продукта, разделен на продукта от концентрациите на реагента, както следва:
Kh = [продукти]
[реактиви]
Работата с константата на хидролизата включва познаване на три важни явления:
- Дисоциация на солите;
- Йонизация на водата;
- Солна хидролиза.
Дисоциация на солите
Когато към вода се добави разтворима сол, тя се дисоциира и отделя катион, различен от хидроний (Н +) и анион, различен от хидроксил (ОН-).

За да ви напомня кога дадена сол е или не е разтворима във вода, Натисни тук и проучете таблицата за разтворимост на солта.
йонизация на водата
Водата е вещество, което по естествен начин претърпява феномена на самойонизация, тоест произвежда хидрониев катион и хидроксилен анион.
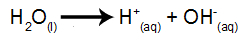
уравнение за йонизация на водата
хидролиза на сол
Като разтворима сол тя отделя йони във водата и водата се подлага на йонизация, като произвежда
йони в средата може да се осъществи реакцията (хидролиза) между солните йони и водните йони. Когато възникне тази реакция, възможните взаимодействия са:- Катион на солта с аниона на водата (образуване на основа);
- Анион на сол с катион на вода (образуване на сол);
Горните взаимодействия ще възникнат само ако образуваната основа или киселина е слаба.
Вижте пример за хидролиза на сол:
→ Хидролиза на амониев хипохлорит (NH4ClO)
Когато към водата се добави амониев хипохлорит, той се разтваря и дисоциира, освобождавайки амониевите катионни йони (NH4 +) и хипохлоритния анион (ClO-):

Уравнение, показващо йоните, освободени при дисоциацията на амониевия хипохлорит
Тъй като водата при йонизация произвежда H + и OH-, в разтвора имаме два катиона и два аниона, които могат да реагират. Катионът NH4 + реагира само с ОН-аниона, тъй като образува слаба основа (NH4OH). ClO-анионът реагира само с катиона Н +, тъй като образува слаба киселина (HClO).

Уравнение за равновесие при хидролиза на амониев хипохлорит
Изграждане на израза на константата на хидролизата
Изграждането на константата на хидролиза на солта зависи изключително от уравнението на хидролизата за тази сол. Хидролизата на амониев хипохлорит например, обработена по предходната точка, генерира следното уравнение:

Уравнение за равновесие при хидролиза на амониев хипохлорит
Как да изградим израза на константа на хидролизата взема предвид продуктите и реагентите, изразът на константата ще бъде:
Kh = [HClO]. [NH4OH]
[ClO -]. [NH4 +]
ЗАБЕЛЕЖКА: Водата не участва в уравнението, тъй като е течен реагент, а също и защото е основното средство за възникване на хидролиза, т.е. е постоянна.
От мен Диого Лопес Диас
Източник: Бразилско училище - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-constante-hidrolise.htm
