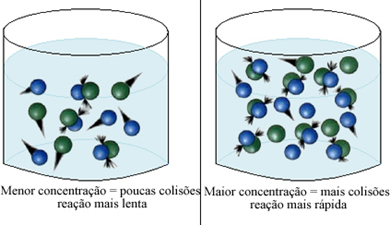
Можем да отбележим това всеки път, когато увеличаваме концентрацията на един или всички реагенти, участващи в химична реакция, се увеличава скоростта на нейното развитие, т.е. скоростта на реакцията.
Вярно е и обратното. Например в момента се препоръчва да използваме алкохолен гел вместо обикновен алкохол, тъй като има по-малък риск от неговото изгаряне и по този начин да се избегнат инциденти. Обикновеният течен алкохол всъщност е смес от алкохол и вода, с гел алкохол, съдържащ по-малко количество алкохол. Следователно, когато концентрацията на един от реагентите на горенето е намалена, в случай на алкохол, реакцията протича по-бавно. От друга страна, колкото по-чист е алкохолът, толкова по-бърза е реакцията на горене.

Както е посочено в текста Условия за възникване на химични реакции, едно от условията за реакция е ефективен сблъсък между частиците. Поради това, увеличаването на концентрацията на реагентите дава възможност да има по-голямо количество частици или молекули, затворени в едно и също пространство. Това увеличава количеството сблъсъци между тях и също така увеличава вероятността да се получат ефективни сблъсъци, които ще доведат до настъпване на реакцията. Резултатът е, че реакцията протича по-бързо.
За да видите това, помислете за следния пример: когато имаме горящ жар и искаме това изгаряне да се обработва по-бързо, духаме ли или раздуваме жаравата? Защо това работи?
Е, един от реагентите в тази реакция на горене е кислородът във въздуха. Когато се разклатим, въздушният поток премахва пепелта, която се образува по време на горенето и това улеснява контакта на кислород с жаравата. По този начин увеличаваме контакта между реагентите и ускоряваме реакцията на горене.
Накратко имаме:

При работа с газове един от начините за увеличаване на концентрацията на реагентите е намалете налягането. Когато правим това, намаляваме обема и следователно има увеличение на концентрациите на реагентите.

От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm
