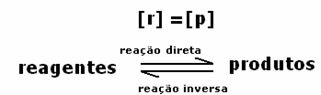
Динамично равновесие или химическо равновесие на реакцията настъпва, когато предните и обратните реакции настъпват едновременно. Тези така наречени обратими системи са представени със стрелки в двете посоки:  или
или  . Пример за обратима реакция е цитиран на изображението по-горе, между йодния газ и водородния газ.
. Пример за обратима реакция е цитиран на изображението по-горе, между йодния газ и водородния газ.
В началото на реакцията количеството на реагентите е максимално, а на продуктите е нула. Реактивите обаче реагират помежду си, намалявайки концентрацията им и увеличавайки тези на образуваните продукти. Скоростта на развитие на директната реакция също намалява.
С увеличаване на концентрацията на продуктите започва обратната реакция и реагентите се образуват отново; увеличава се и скоростта на развитие на обратната реакция.
При достигане на химическо равновесие, при постоянна температура, скоростите на развитие на пряката и обратната реакция са равни.
всичкодиректен = Всички обратна
Цените са еднакви, но концентрациите не са. Концентрациите на реагентите и продуктите е малко вероятно да бъдат еднакви. Само в редки случаи това се случва. В повечето случаи концентрацията на реагентите ще бъде по-висока от тази на продуктите или обратно.
По този начин имаме три възможни начина да представим графично темповете на развитие на директни и обратни реакции, отнасящи се до концентрациите на реагенти и продукти над време. Нека разгледаме всеки случай:
1-ви случай: Равни концентрации:
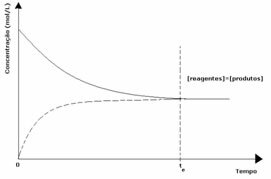
Както се вижда на графиката, в момент tи предните и обратните реакции са еднакви, като в този случай концентрациите на реагентите и продуктите са еднакви. По този начин балансът не се измества в нито една страна, интензивността на двете реакции е еднаква, както е изразено по-долу:
2-ри случай: Концентрация на реагенти, по-голяма от концентрацията на продукти:
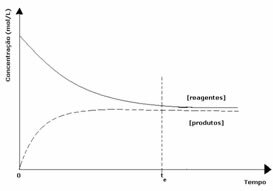
В този случай се наблюдава, че при достигане на равновесие концентрацията на реагентите е по-голяма от тази на продуктите. Така се стига до извода, че ако има повече реагент, обратната реакция протича с по-голяма интензивност. Реакцията се измества наляво:
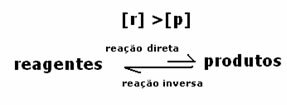
3-ти случай: Концентрация на продукти по-голяма от тази на реагентите:
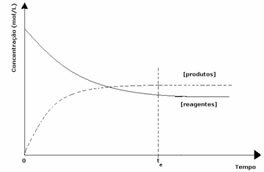
Тъй като при равновесие концентрацията на продукти е по-голяма, това означава, че реакцията е изместена надясно, тъй като директната реакция (с образуване на продукти) протича с по-голяма интензивност.
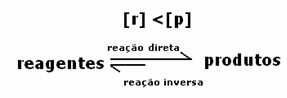
Това, което ще покаже дали реакцията клони надясно или наляво, ще бъде равновесната константа К, която зависи само от температурата.
От Дженифър Фогаса
Завършва химия
Училищен отбор на Бразилия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm
