Окисление е името, дадено на процеса на загуба на електрони от атом, група или йонен вид по време на a химическа реакция. Той се идентифицира от увеличаването на NOX (окислителен брой) на вида или атома при сравняване на реагент и продукт.
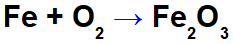
Уравнение за окисление на желязото.
В уравнението по-горе, например, можем да посочим NOX на всеки от участниците:
Реактивно желязо (Fe): има NOX 0, тъй като е a проста субстанция;
Кислород в реагента (O): има NOX 0, тъй като е просто вещество;
Кислород в продукта: съдържа NOX -2, тъй като не е свързан с алкален метал, алкална земя или образуване на водород пероксиди или супероксиди;
Желязо в продукта: има NOX +3, тъй като сборът от NOX на желязото, умножен по 2 (брой атоми) + NOX на кислорода, умножен по 3, трябва да доведе до 0, тъй като това е съединение:
x.2 + 3.(-2) = 0
2x - 6 = 0
2x = +6
х = + 6
2
х = +3
Сравнявайки NOX на реактивното желязо (0) с продукта (+3), наблюдавахме увеличение, тоест той претърпя процес на окисляване. Струва си да се отбележи, че появата на
окисляване той винаги е придружен от явлението на редукция (което означава усилване на електроните), идентифицирано от намаляването на NOx, както се случва с кислорода в примера.Прочетете също:Определяне на окислително число (NOX)
Примери за ситуации, при които настъпва окисляване:
1. Изгаряне

Изгарянето на даден материал също е показателно за окисляване.
Изгаряне е всяка химическа реакция, която протича в присъствието на a гориво всеки и окисляващият кислород газ (O2), което води до производството на топлина и светлина. При всяко горене възниква реакция окисляване.
2. Някои органични реакции
При всяка органична реакция, която протича в присъствието на изброените по-долу средства, процесът на окисляване:
Калиев дихромат (К2Кр2О7) или калиев перманганат (KMnO4);
Наличие на силна киселина или силна основа;
Газ озон (О3) в присъствието на метален цинк (Zn) и вода (H2О).
3. Батерии или батерии

Батериите са устройства, в които винаги се случва окисляване.
Стекове или батериите са електрохимични устройства, които съхраняват химически вещества. Едно от тези вещества ще претърпи окисление, а другото ще претърпи редукция, което ще доведе до производството на електрически ток.
4. Електролиза
Електролиза е химичен процес, при който воден разтвор, съдържащ сол, се подлага на електрически ток, който в крайна сметка насърчава окисляването на аниони, присъстващи в тези материали. При всяка електролиза има окисляване.
От мен Диого Лопес Диаш
Източник: Бразилско училище - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-oxidacao.htm