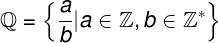Един полярно съединение (или вещество) е този, който има две области с различна електронна плътност. Един от тези региони има положителен характер (бяла зона), а друг има отрицателен характер (жълта зона), както можем да видим в следното представяне:

Представяне на области с различен заряд в полярно съединение
Знайте дали определено композитът е полярен предполага познаване на вида междумолекулна сила, която благоприятства взаимодействието между нейните молекули или с молекули на други вещества, както и да се правят предположения за тяхната разтворимост и точки на топене и кипене.
Например: по отношение на разтворимостта, полярните съединения имат добра способност да се разтварят в полярни съединения. Що се отнася до междумолекулните сили, в зависимост от случая, полярните съединения могат да взаимодействат чрез сили постоянни диполни или водородни връзки (сила, която също води до по-високи точки на топене и кипене).
Ето два практически начина да определите дали дадено съединение е полярно или не.
Определяне на полярността чрез броя на облаците и броя на лигандите
Можем да определим дали a композитът е полярен чрез връзката между броя на равните атоми, прикрепени към централния атом, и броя на електронните облаци в този централен атом.
Забележка: Електронен облак е всяка химическа връзка между два атома или двойка електрони от валентната обвивка на атома, които не участват във връзка.
Ако броят на облаците, присъстващи в централния атом, е различен от броя на равни лиганди в този централен атом, имаме полярно съединение. За да разберете по-добре, следвайте примерите по-долу:
1-ви пример: Молекула на циановодородната киселина

Структурна формула на циановодородна киселина
В циановодородната киселина централният атом е въглеродът, който има четири електрона валентен слой за принадлежност към семейството на IVA на периодичната таблица. Как въглеродът прави единична връзка (споделяйки два електрона, с един електрон от всеки атом участва) с водород и тройна връзка с азот, така че в атома няма несвързващи електрони централна.
Така в циановодородната киселина има наличие на два електронни облака (единична връзка и тройна връзка) и лиганд, равен на другия. Следователно, това е a полярно съединение.
2-ри пример: Молекула на амоняк (NH3)

Структурна формула на амоняк
В амоняка централният атом е азотът, който има пет електрона във валентната си обвивка, тъй като принадлежи към семейството на VA на периодичната таблица. Тъй като азотът създава единична връзка (споделяне на два електрона, с един електрон на всеки участващ атом) с всеки водороден атом два от петте му електрона не участват в връзки.

Несвързващи азот електрони в амоняк
Така в амоняка има четири електронни облака (три единични връзки и несвързваща електронна двойка) и три равни лиганда (трите водорода). Така че това е а полярно съединение.
Определяне на полярността чрез вектора на диполния момент на съединение
Можем да определим дали a композитът е полярен чрез анализа на резултантния вектор на диполен момент в структурната си формула, като се вземе предвид нейната молекулярна геометрия и разликата на електроотрицателност между участващите атоми.
Забележка: Низходящ ред на електроотрицателността на елементите: F > O > N > Cl > Br > I > S > C > P > H.
Когато сумата от векторите, присъстващи в молекулата, е различна от нула, съединението ще бъде полярно. За да разберете по-добре, следвайте следните примери:
1-ви пример: трихлорометанова молекула
Трихлорометанът е съединение, което присъства тетраедрична геометрия, както можем да видим в структурната му формула по-долу:

Структурна формула на трихлорометан
За да разберем дали е полярно съединение или не, трябва първоначално да поставим векторите на диполния момент (стрелките, които показват кой атом е по-стабилен от другия) в структурния, както е в следния пример:
Забележка: Хлорът е по-електроотрицателен елемент от въглерода. От своя страна въглеродът е по-електроотрицателен елемент от водорода.

Вектори на диполния момент в трихлорометан
Векторите в розово могат да бъдат представени с +x и -x, тъй като имат една и съща посока (вертикална) и противоположни посоки (нагоре и надолу). Векторите в червено са представени с +x, тъй като имат една и съща посока и една и съща посока. По този начин полученият вектор на диполен момент (сума от векторите) е представен от:
μr = (+x) + (-x) + (+x) + (+x)
μr = +X – x + x + x
μr = 2x
Тъй като полученият вектор на диполен момент е различен от нула, имаме a полярно съединение.
2-ри пример: водна молекула
Водата е съединение, което се представя ъглова геометрия, както можем да видим в структурната му формула по-долу:

Структурна формула на водата
За да разберем дали е полярно съединение или не, трябва първоначално да поставим векторите на диполния момент (стрелките, които показват кой атом е по-стабилен от другия) в структурата, както е показано по-долу:
Забележка: Кислородът е по-електроотрицателен елемент от водорода.

вектори на диполен момент във вода
Тъй като двата вектора в структурата на водата са диагонално напречни, трябва да използваме правилото на успоредника. В това правило, когато свързваме базите на векторите, имаме създаването на резултатен вектор (който замества двата използвани преди), както в следния модел:

Получен вектор в структурната формула на водата
Тъй като водната молекула има един вектор, следователно, полученият вектор на диполен момент е различен от нула, тоест имаме полярно съединение.
От мен Диого Лопес Диаш
Източник: Бразилско училище - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-composto-polar.htm