Атом е името, дадено на създателя на материята (всичко, което заема пространство и има маса). Това име е предложено от гръцките философи Демокрит и Левкип. Химични елементи, молекули, вещества а органичните или неорганичните материали се образуват от атоми.
В своята конституция атомът има частици (протони, неутрони и електрони), които не са най-малката част от материята. Все още, вашата визуализация не е възможна. Това, което е известно за атома, е свързано с научно доказани физични, химични и математически аспекти.
Еволюцията на знанията за атома доведе до разработването и усъвършенстването на няколко технологии.
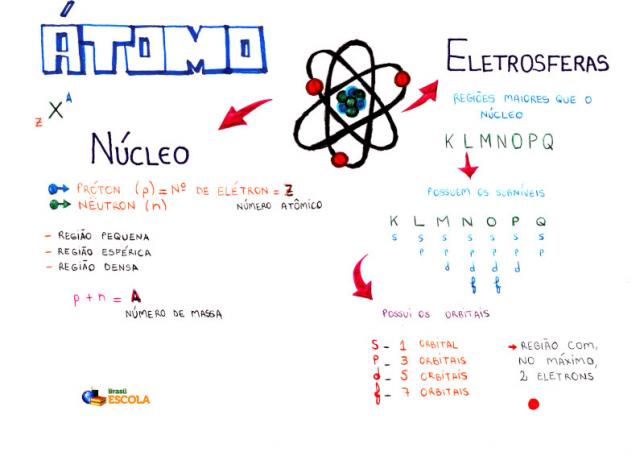
Основен състав на атом
Ядро: по-плътна област на атома и съдържа протони и неутрони;
Енергийни нива: региони, които заобикалят ядрото и в които се намират поднива, орбитали и електрони. Има седем енергийни нива, които са представени с буквите K, L, M, N, O, P и Q;
Енергийни поднива: са региони, в които се намират орбиталите. Те присъстват на всички нива и са представени с букви (s, p, d f). Количеството му зависи от всяко ниво: K (има s поднива), L (има s и p поднива), M (има s, p и d поднива), N (има поднива s, p, d и f), O (има поднива s, p, d и f), P (има поднива s, p и d) и Q (има поднива s и Р);
Атомни орбитали: региони с най-голяма вероятност да намерят електрон. Всяко подниво има различен брой орбитали: s (една орбитала), p (три орбитали), d (пет орбитали) и f (седем орбитали);
протони: положителни частици (представени с p);
електрони: отрицателни частици, които също имат поведение на вълната (представено с e);
неутрони: незаредени частици, които намаляват отблъскването между протоните в ядрото (представено с n).
Карта на ума: Атом
* За да изтеглите мисловната карта в PDF, Натисни тук!
представяне на атом
Най-простият начин да се представи атом е да се използва съкращението на химичния елемент, който той образува. Съкращението Se, например, представлява всички атоми, които образуват химичния елемент селен.
Съкращението, което представлява атома, все още може да предостави две важни информации: атомният номер (представен с буквата Z и винаги от лявата страна дъното на съкращението на атома) и масовия номер (представен с буквата А, която може да бъде позиционирана отляво или отдясно в горната част на съкращението на атома атом).
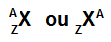
Съкращение от атом с масово число и атомен номер
атомно число (Z): показва броя на протоните, присъстващи в ядрото на атома, и броя на електроните (д), присъстващи в енергийните нива.
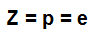
Формула, която показва представителността на атомния номер
Масов номер (A): показва масата, присъстваща в ядрото на атома, която се получава от сумата от броя на протоните (p) и броя на неутроните (n).

Формула, която показва представителността на масовото число
Атомни прилики
Атомите на един и същ химичен елемент или различни химични елементи могат да бъдат сравнени по отношение на броя на протоните, електроните, неутроните и масата, като се класифицират, както следва:
а) Изотопи
Те са атоми, които имат:
същия атомен номер;
същия брой протони;
различно масово число;
различен брой неутрони;
Пример:
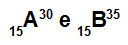
Атомите А и В са изотопи
Атомите А и В са изотопи, защото:
Атом А има 15 протона, атомно число, равно на 15, 15 електрона, 15 неутрона и масово число, равно на 30.
Атом В има 15 протона, атомно число, равно на 15, 15 електрона, 20 неутрона и масово число, равно на 35.
б) Изобари
Те са атоми, които имат:
различни атомни номера;
различен брой протони;
различен брой електрони;
същите масови числа;
различен брой неутрони.
Пример:
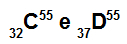
Атомите C и D са изобари
Атомите C и D са изобарни, защото:
Атом С има 32 протона, атомен номер, равен на 32, 32 електрона, 23 неутрона и масово число, равно на 55.
Атом D има 37 протона, атомен номер, равен на 37, 37 електрона, 18 неутрона и масово число, равно на 55.
в) Изотони
Те са атоми, които имат:
различни атомни номера;
различен брой протони;
различен брой електрони;
различни масови числа;
същия брой неутрони.
Пример:
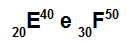
Атомите E и F са изотопи
Атомите E и F са изотопи, защото:
Атом Е има 20 протона, атомно число, равно на 20, 20 електрона, 20 неутрона и масово число, равно на 40.
Атом F има 30 протона, атомно число, равно на 30, 30 електрона, 20 неутрона и масово число, равно на 50.
г) Изоелектроника
Те са атоми, които имат:
същия брой електрони.
ЗАБЕЛЕЖКА: изоелектронните атоми също могат да имат еднакво масово число (изобари), същия брой неутрони (изотони) или еднакъв брой протони (изотопи).
Пример:
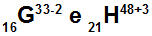
Атомите G и H са изоелектронни
Атомите G и H са изоелектронни, защото:
Атом G има 16 протона, атомен номер, равен на 16, 18 електрона (знакът -2 показва, че има два електрона повече от броя на протоните), 17 неутрона и масово число, равно на 33.
Атом Н има 21 протона, атомен номер, равен на 21, 18 електрона (знакът +3 показва, че има три по-малко електрони от броя на протоните), 27 неутрона и масово число, равно на 48.
От мен Диого Лопес Диас
Източник: Бразилско училище - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-atomo.htm

