Kps е съкращението, използвано за представяне на разтворимост продукт константа, което се отнася до произведението (умножение) на концентрации в количество вещество на йоните, присъстващи в разтвор.
Всеки път, когато към разтворител като бариев сулфат се добави слабо разтворимо разтворено вещество, малко количество част от тази сол се разтваря във водата, а останалата част се натрупва в дъното на контейнера, образувайки тялото на заден план. Солта, която се разтваря, страда дисоциация, освобождавайки катиони и аниони във водата.

Утаява се в разтвор с вода и бариев сулфат
Освен това солта не представлява добро разтворимост, количеството на разтвореното разтворено вещество не се променя с течение на времето, защото има равновесие на разтваряне между солните йони (присъстващи в разтвора) и фоновото тяло.

BaSO Баланс за разтваряне4 във вода
Kps на разтворено вещество
О Kps на разтворено вещество е продукт на моларните концентрации на участващите йони. Винаги е необходимо да се повиши концентрацията на йони до съответния му стехиометричен коефициент (използван за балансиране на уравнението).

Равновесие на разтваряне на електролит YTheхБ.
О Kps от предложеното равновесие за сол YTheхБ. той ще има концентрацията на реагент Y (повишена до неговия стехиометричен коефициент (a) и концентрацията на продукт X (повишена до неговия стехиометричен коефициент (b)).
Kps = [Y+ b]The.[Х-Това]Б.
Пример
Да предположим, че подготвяме разтвор с вода и алуминиев цианид [Al (CN)3], която е практически неразтворима сол във вода. Когато тази сол се добави към водата, тя в крайна сметка страда от феномена на дисоциация.

Равновесие на разтваряне на електролит Al (CN)3
И така, чрез уравнението на равновесието на разтварянето на солта имаме това Kps ще има умножение на концентрацията на алуминиевия катион (Al+3), повишен до степен 1 от концентрацията на цианиден анион (CN-1) повишен до степен 3.
Kps = [Al+3]1[CN-1]3
Kps значения на разтворено вещество
Когато намерим Kps на определена сол, смесена с вода, ние също знаем концентрацията на всеки от йоните в разтвора. С тези данни можем да определим класирането на разтвора или поведението на разтвореното вещество в разтвора. Помислете за следния баланс:

Равновесие на разтваряне на електролит YTheхБ.
Можем да направим следните взаимоотношения:
Ако Kps = [Y+ b]The.[Х-Това]Б. = 0, имаме наситен разтвор без наличие на утайка;
Ако Kps> [Y+ b]The.[Х-Това]Б. = 0, имаме ненаситен разтвор, т.е.малко количество разтворено вещество, разтворено в разтворителя (по отношение на коефициент на разтворимост);
Ако Kps + b]The.[Х-Това]Б. = 0, имаме наситен разтвор с дънно тяло, тоест ще има утаяване на електролита (разтвореното вещество);
Ако стойността на Kps на електролита е твърде ниска, това е слабо разтворим материал в разтворителя.
Пример за Kps изчисление на разтворено вещество
(UERN): Разтворимостта на калциев нитрат [Ca (NO3)2] във вода е 2,0. 10–3 mol / литър при определена температура. Kps на тази сол при същата температура е:
а) 8.10–8.
б) 8.10–10.
в) 3.2.10–10
г) 3.2.10–8
Данни за упражнения:
Формула на сол: Ca (NO3)2;
Концентрация на моларна сол (разтворимост): 2.0. 10–3 mol / L.
За да решите и изчислите Kps, трябва да направите следното:
Етап 1: Настройте баланса за разтваряне на солта.
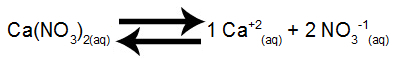
Равновесие на разтваряне на калциев нитрат във вода
Калциевият нитрат, когато претърпява дисоциация във вода, отделя 1 mol калциеви катиони (Ca+2) и 2 mol нитратни аниони (NO3-1).
Стъпка 2: Съберете израза на Kps на солта
Kps на тази сол ще бъде продукт на концентрацията на калциев катион, повишена до степен 1 от концентрацията на нитратен анион, повишена до степен 2, както е показано по-долу:
Kps = [Ca+2]1[НА3-1]2
Стъпка 3: Определете стойностите на концентрациите на йони в разтвора
За да изчислим Kps, са ни необходими стойностите на концентрациите на йони, но упражнението осигурява моларността на солта в разтвора. За да определите концентрацията на всеки йон, просто умножете моларността на солта по стехиометричния коефициент на участника в реакцията:
За калциев катион:
[Тук+2] = 1. 2,0. 10–3
[Тук+2] = 2,0. 10–3 mol / L
За нитратния анион:
[НА3-1] = 2. 2,0. 10–3
[НА3-1] = 4,0. 10–3 mol / L
Стъпка 4: Използвайте стойностите на концентрацията, намерени в стъпка 3 в израза Kps (определена в стъпка 2).
Kps = [Ca+2]1[НА3-1]2
Kps = [2.10-3]1.[4.10-3]2
Kps = 2.10-3.16.10-6
Kps = 32.10-9
или
Kps = 3.2.10-9 (месечно / л)
От мен Диого Лопес Диас
Източник: Бразилско училище - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kps.htm


