Вие газове те са течности които за разлика от течностите заемат цялото налично пространство на контейнера, където са затворени. Молекулите, които изграждат газовете, са свободни да се движат и взаимодействат помежду си и със стените на контейнера.
О перфектен или идеален газ това е идеализиран газ, има специфични характеристики и отговаря на общ закон за газа и Уравнението на Клапейрон.
Характеристики на перфектните газове
Няма гравитационно взаимодействие между молекулите;
В сблъсъци сред молекулите са идеално еластична, тоест има цялостно запазване на кинетичната енергия;
Молекулите проявяват безпорядъчно движение и скорости, които зависят пряко от стойността на температурата на газа;
Подходящият обем на всяка молекула е напълно незначителен в сравнение с общия обем на газа.
променливи на състоянието
Налягане, температура и обемът са скаларни физически величини които характеризират газ. Тези величини се наричат променливи на състоянието и поддържат връзки на пропорционалност.
НА закон на Бойл
определя, че връзката между налягането и обема на даден газ е обратно пропорционална. Колкото по-голям е натискът върху молекулите, толкова по-малко място заемат те.НА Гей-Лусак законопределя, че връзката между обема и температурата на даден газ е право пропорционална. Колкото по-висока е температурата на даден газ, толкова по-голямо е раздвижването на молекулите, които са склонни да се раздалечават, увеличавайки заеманото от тях пространство.
Законът на Чарлз определя, че връзката между налягането и температурата на даден газ е право пропорционална. Колкото по-висока е температурата на даден газ, толкова по-голямо е молекулярното разбъркване. По този начин честотата на сблъсъци между молекулите и стените на контейнера се увеличава, което прави налягането на газа по-голямо.
НА уравнение на клапейрон той синтезира трите закона, представени по-горе, и определя единна връзка между променливите на състоянието.
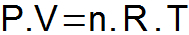
P = налягане на газа (atm или N / m2);
V = обем на газа (L или m3);
n = брой бенки;
R = универсална газова константа (0,082 atm.l / mol. K или 8,31 J / mol. К);
Т = температура на газа (K).
Идеален газ в природата
Природата не произвежда газове, които имат характеристиките на перфектен газ. Идеалният газ е теоретичен и полезен модел за разбиране на поведението на газовете при промени в техните характеристики.
От Йоав Силас
Завършва физика
Източник: Бразилско училище - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-gas-perfeito.htm
