Когато казваме думата „баланс“, на ум ни идва обект, който остава за неопределено време. Това обаче е само един вид баланс, наречен „Статично равновесие“.
Има и „Динамично равновесие“. В него, както казва името, няма нито един момент, в който въпросният обект или явление да са все още. Например, за да разберете, вижте илюстрацията по-долу и отбележете, че количеството вода, което попада в контейнера, е равно на количеството, което изтича от него, поддържайки нивото на водата постоянно. В този случай казваме, че има динамичен баланс, баланс в движение.

Това е този вид баланс, който се случва в обратими реакции, тоест при онези реакции, които протичат и в двете посоки. В същото време, когато молекулите на реагентите се трансформират в продуктите, молекулите на продуктите реагират помежду си, образувайки реагентите. Обратимостта на реакцията е представена със стрелки в двете посоки:
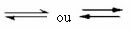
Когато скоростта на развитие на директната реакция (на образуване на продуктите) е равна на скоростта на развитие на обратна реакция (образуване на реагенти), при постоянна температура, означава, че реакцията е достигнала равновесие химически. И в случай на реакции с присъствие само на молекули в реагентите и продуктите, имаме a молекулен баланс.
Не спирайте сега... Има още след рекламата;)
Следва пример за реакция, която протича между газообразен водород (Н2) и йоден газ (I2), за образуването на газ от водороден йодид (HI):
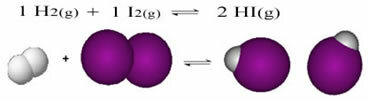
В началото на реакцията скоростта на развитие на директната реакция беше по-висока, след като концентрацията на реагентите беше максимална, а на продуктите нула. Така че скоростта на развитие на обратната реакция също беше нула.
С течение на времето обаче водородните и йодните газове реагират, генерирайки продукта. По този начин концентрацията на реагентите започва да намалява и скоростта им на развитие също намалява.
Тъй като концентрацията на продуктите се увеличава и концентрацията на реагентите намалява, скоростта на развитие на обратната реакция започва да се увеличава. Ако температурата се поддържа постоянна, ще настъпи момент, когато двете скорости на развитие ще останат същите, като по този начин се покаже, че реакцията е достигнала химическо молекулярно равновесие.
От Дженифър Фогаса
Завършва химия
Искате ли да се позовавате на този текст в училище или академична работа? Виж:
FOGAÇA, Дженифър Роча Варгас. „Молекулен баланс“; Бразилско училище. Наличен в: https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm. Достъп на 28 юни 2021 г.