О Диаграма на фазите е графика, която ви позволява да определите в какво физическо състояние се намира дадено вещество по всяко време, като знаете температурата и налягането му.
Лабораторните измервания се използват за изграждане на фазова диаграма на дадено вещество.
Диаграмата е разделена на три области, които представляват твърдо, течно и изпарено състояние.
Точките на линиите, които ограничават тези области, показват стойностите на температурата и налягането, които веществото може да бъде в две състояния.
Фазовата диаграма има следните елементи:
- крива на Сливане: разделя областите, които съответстват на твърдо и течно състояние.
- крива на изпаряване: разделя областите, съответстващи на течната и парна фаза.
- крива на сублимация: разделя областите, съответстващи на твърдата и парна фази.
- тройна точка: пресечна точка на трите криви (синтез, изпаряване и сублимация). Тази точка показва стойностите на температурата и налягането, които веществото може да бъде едновременно в трите състояния.
- Критична точка: показва най-високата температура, че веществото е пара. От този момент нататък вече не е възможно да се прави разлика между течно и парно състояние. При температури над критичната точка веществото се превръща в газ.
На фигурата по-долу представяме представяне на фазова диаграма:

Прочетете повече на: Промени в физическото състояние.
крива на топене
Веществата като цяло увеличават обема си, когато се подлагат на синтез и, напротив, намаляват обема си, когато се втвърдят. В резултат на това повишаването на налягането води до увеличаване на точката на топене (температурата на топене).
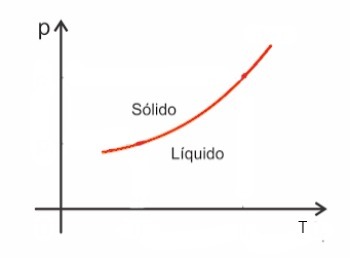
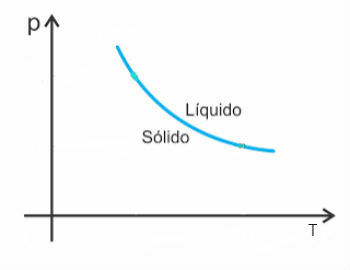
Има обаче някои изключения сред тях вода, която при топене намалява по обем. В този случай повишаването на налягането води до намаляване на температурата на топене.
По този начин кривата на топене на тези вещества ще изглежда така:
Пример
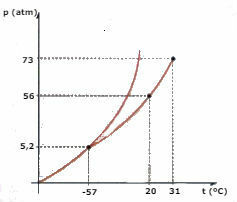
Помислете за фазовата диаграма на CO2 (въглероден диоксид) представен по-долу и отговорете на въпросите:
а) Каква фаза е CO2 , когато температурата ви е -60 ° C и налягането е 50 атм?
б) Определено количество CO2 течността се подлага на налягане от 56 атм и се затваря в контейнер. Ако течността се нагрява, поддържайки налягането постоянно, каква е температурната стойност, при която ще се получи изпаряване?
в) Каква е стойността на температурата и налягането на тройната точка на CO2?
г) Парче сух лед (CO2) се подлага на налягане от 2 атм. Нагрява се, поддържайки постоянно налягане. В определен момент започва да настъпва фазова промяна. Какво е името на тази промяна?
Резолюция:
а) Наблюдавайки диаграмата, заключаваме, че CO2 ще бъде в твърда фаза.
б) Изпаряване ще настъпи, когато температурата достигне 20 ° C.
в) Тройната точка съответства на пресичането на трите криви, в случая на CO2, когато има температура от -57 ° C и налягане от 5,2 атм, трите физически състояния могат да съществуват едновременно.
г) Ще настъпи сублимация
За да научите повече, прочетете също:
- Втвърдяване
- Точка на топене и кипене
- Изпаряване
- Кондензация
Решени упражнения
1) Енем - 2000
Дори и днес е много често хората да използват глинени съдове (буркани или неглазирани керамични саксии), за да пестят вода при температура, по-ниска от тази на околната среда. Това е така, защото:
а) глината изолира водата от околната среда, като винаги я поддържа при по-ниска температура от нейната, сякаш е стиропор.
б) глината има силата да „замразява“ водата поради своя химичен състав. В реакцията водата губи топлина.
в) глината е пореста, позволяваща на водата да преминава през нея. Част от тази вода се изпарява, като отнема топлина от моринга и останалата част от водата, които след това се охлаждат.
г) глината е пореста, позволяваща на водата да се утаи от външната страна на кана. Външната вода винаги е с по-висока температура от вътрешната.
д) Moringa е вид естествен хладилник, отделящ хигроскопични вещества, които естествено намаляват температурата на водата.
Алтернатива c: глината е пореста, позволяваща на водата да премине през нея. Част от тази вода се изпарява, като отнема топлина от моринга и останалата част от водата, които след това се охлаждат.
2) Ита - 2013
Помислете за хипотетичната фазова диаграма, схематично представена на следващата фигура:

Какво представляват точки A, B, C, D и E?
точка А: точка на сублимация
точка Б: тройна точка
Точка С: точка на топене / втвърдяване
точка D: точка на изпаряване / кондензация
точка Е: критична точка
3) UECE - 2009
Разглеждайки диаграмата на PT фаза, показана по-долу Правилно може да се заключи, че вещество, преминало през процеса на сублимация, следва траекторията:

а) X или Y
б) Y или U
в) U или V
г) T или X
Алтернатива b: Y или U

