Химичната кинетика изучава скоростта на химичните реакции и факторите, които влияят върху скоростта на тези реакции.
Използвайте въпросите по-долу, за да проверите знанията си и да проверите коментарите към резолюциите.
Въпрос 1
По отношение на факторите, които влияят на скоростта на химична реакция, НЕПРАВИЛНО е да се твърди, че:
а) Колкото по-висока е концентрацията на реагентите, толкова по-бърза е реакцията.
б) Колкото по-голяма е контактната повърхност, толкова по-голяма е скоростта на реакцията.
в) Колкото по-високо е налягането, толкова по-бърза е реакцията.
г) Колкото по-висока е температурата, толкова по-бърза е реакцията.
д) Наличието на катализатор поддържа скоростта на реакцията постоянна.
Неправилна алтернатива: д) Наличието на катализатор поддържа скоростта на реакцията постоянна.
Катализаторите увеличават скоростта на реакцията, тъй като улесняват образуването на активирания комплекс между реагентите.
С това катализаторите създават по-кратък механизъм за развитие на реакцията, което води до увеличаване на скоростта.
въпрос 2
Според _____________ трябва да възникнат ефективни сблъсъци между реагентите за образуване на продуктите. Освен това има достатъчно ___________, за да се разкъсат химическите връзки на реагентите и да се образува ___________, което е междинно състояние преди образуването на продукти.
Думите, които правилно попълват празните места, са съответно:
а) енталпия, кинетична енергия и изменение на катализатора.
б) теория на сблъсъка, енергия на активиране и активиран комплекс.
в) скорост на реакция, енталпия и инхибитор.
г) парциално налягане, ентропия и субстрат.
Правилна алтернатива: б) теория на сблъсъка, енергия на активиране и активиран комплекс.
Според теорията на сблъсъците сблъсъците между реагентите са необходими за възникване на химична реакция. За това веществата трябва да са в благоприятно положение, за да бъдат ефективни шоковете.
Енергията на активиране действа като енергийна бариера, която трябва да бъде преодоляна, за да се разрушат връзките на реагиращите съединения. Колкото по-ниска е енергията на активиране, толкова по-бърза е реакцията.
Активираният комплекс е нестабилен междинен вид, образуван преди продуктите.
въпрос 3
Следните четири твърдения са направени относно катализаторите:
I. Катализаторът работи, като увеличава скоростта на реакцията, но не променя нейните характеристики.
II. При химическа реакция катализаторът не се изразходва по реакционния път.
III. Катализаторите създават алтернативен път за трансформиране на реагентите в продукти. За това е необходима по-голяма енергия за активиране.
IV. Катализаторът е способен да ускори реакцията само в посока напред.
Опциите, които представят правилна информация за катализаторите, са:
а) I и II
б) II и III
в) I и IV
г) Всички
Правилна алтернатива: а) I и II.
Катализаторите се използват за ускоряване на химичните реакции. Реакцията с използване на катализатора не променя добива си, т.е. очакваното количество от продукта се получава, но за по-малко време.
По време на химичната реакция не се консумират катализатори, те помагат за образуването на активирания комплекс. Следователно, катализатор може да бъде възстановен в края на химичната реакция.
Катализаторите са в състояние да намалят времето за реакция чрез създаване на алтернативен механизъм за образуване на продукти с по-ниска енергия на активиране. Следователно реакцията протича по-бързо.
Катализаторите действат както в посока напред, така и в обратна посока на реакцията.
въпрос 4
Колко бързо протича химическата реакция зависи от:
I. Брой ефективни сблъсъци между реагентите.
II. Достатъчно енергия за пренареждане на атомите.
III. Благоприятна ориентация на молекулите.
IV. Образуване на активиран комплекс.
а) I и II
б) II и IV
в) I, II и III
г) I, II, III и IV
Правилна алтернатива: г) I, II, III и IV.
Ефективни сблъсъци се получават, когато реагентите са в позиции, благоприятни за удари, което ще насърчи пренареждането на атомите.
Енергията на активиране трябва да е достатъчна, за да може сблъсъкът между реагентите да доведе до скъсване на връзките и образуване на активирания комплекс.
Не всички сблъсъци между реагиращи частици водят до реакцията. Ориентацията, с която се случва сблъсъкът, е важна за образуването на продуктите, които ще възникнат.
Активираният комплекс е междинно и нестабилно състояние преди образуването на продукти. Той се създава, когато енергията за активиране на реакцията е превишена.
въпрос 5
Въглеродният диоксид е газ, образуван от реакцията между въглероден окис и кислородни газове, съгласно химичното уравнение по-долу.
CO(ж) + ½2 (g) → CO2 (g)
Знаейки, че за 5 минути реакция са изразходвани 2,5 mol CO, каква е скоростта на развитие на реакцията според консумацията на O2?
а) 0,2 mol. мин-1
б) 1,5 mol. мин-1
в) 2,0 mol. мин-1
г) 0,25 mol. мин-1
Правилна алтернатива: г) 0,25 мола. мин-1
За да отговорим на този въпрос, трябва да разгледаме химичното уравнение.
CO(ж) + ½2 (g) → CO2 (g)
Имайте предвид, че 1 мол въглероден оксид реагира с ½ мол кислород, образувайки 1 мол въглероден диоксид.
Количеството, дадено в изявлението, се отнася до въглероден окис, но отговорът трябва да бъде по отношение на кислорода. За това трябва да изпълним правило от три и да намерим количеството кислород.
1 mol CO - ½ mol O2
2,5 mol CO - x от O2
х = 1,25 мола
Сега прилагаме стойностите във формулата за скоростта на развитие на реакцията.
Следователно скоростта на развитие на реакцията по отношение на кислорода е 0,25 mol.min-1.
въпрос 6
Обърнете внимание на графичното представяне на развитието на хипотетична химическа реакция, която свързва енергията и реакционния път.
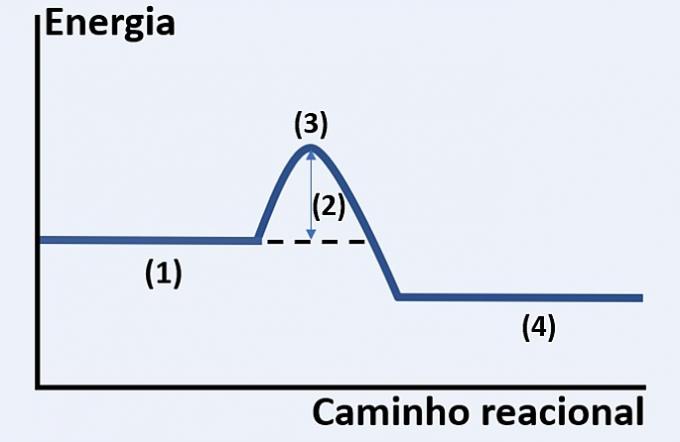
Проверете алтернативата, която правилно замества съответно (1), (2), (3) и (4).
а) субстрати, отделена топлина, максимално енергийно състояние и край на реакцията.
б) реагенти, активираща енергия, активиран комплекс и продукти.
в) реактиви, кинетична енергия, катализатор и субстрати.
г) реактиви, абсорбирана топлина, топлинна енергия и продукти.
Правилна алтернатива: б) реагенти, активираща енергия, активиран комплекс и продукти.
Показаната графика е на ендотермична реакция, т.е. има абсорбция на енергия, за да настъпи реакцията.
Вие реагенти (1) са в началото на графиката и активираща енергия (2) съответства на разликата между енергията, съхранявана в реагентите и в активиран комплекс (3). И накрая, след преминаване на междинното състояние, образуването на продукти (4).
Следователно, реагентите трябва да преодолеят енергията на активиране, за да пренаредят своите атоми в междинна структура, наречена активиран комплекс, за да се образуват продуктите.
въпрос 7
Вещество А е способно да се разложи и да стане вещество Б. Наблюдавайте развитието на тази реакция на изображението по-долу.

По отношение на скоростта на реакцията можем да кажем, че:
а) Вещество А се разлага между 0 и 15 s със скорост 0,35 mol.s-1.
б) Вещество А се разлага между 15 и 30 s със скорост 0,02 mol.s-1.
в) Вещество А се разлага между 0 и 15 s със скорост 0,04 mol.s-1.
г) Вещество А се разлага между 15 и 30 s със скорост 0,03 mol.s-1.
Правилна алтернатива: г) Вещество А се разлага между 15 и 30 s със скорост 0,03 mol.s-1.
Скоростта на разлагане на вещество А може да се изчисли по формулата:
Нека изчислим скоростта на реакцията по отношение на вещество А между дадените интервали.
Обхват между 0 и 15:
Обхват между 15 и 30:
Следователно алтернатива d е правилна, тъй като вещество А се разлага между 15 и 30 s със скорост 0,03 mol.s.-1.
въпрос 8
Помислете за следната хипотетична реакция.
aA + bB → cC + dD
Обърнете внимание на вариацията в концентрацията на А и С по-долу.
| Време (а) | 0 | 5 | 10 | 15 | 20 | 25 |
|---|---|---|---|---|---|---|
| Консумация на A (mol / L) | 7,5 | 6,0 | 4,5 | 3,0 | 2,5 | 1,0 |
| Образуване на C (mol / L) | 0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
Въз основа на информацията, предоставена във въпроса, каква е съответно скоростта на консумация на А и скоростта на образуване на С в интервала между 5 и 25 минути?
а) 0,3 mol. L-1.с-1 и 0,1 mol. L-1.с-1
б) - 0,1 mol. L-1.с-1 и 0,3 mol. L-1.с-1
в) - 0,25 mol. L-1.с-1 и 0,1 mol. L-1.с-1
г) 0,1 mol. L-1.с-1 и 0,3 mol. L-1.с-1
Правилна алтернатива: в) - 0,25 мола. L-1.с-1 и 0,1 mol. L-1.с-1.
Норма на потребление:
C степен на обучение:
Следователно в реакцията А се консумира със скорост 0,25 mol.s-1, така че стойността му е отрицателна, докато B се образува със скорост 0,1 mol. L-1.с-1.
Прочетете и вие:
- Химическа кинетика
- термохимия
- Химичен баланс
- Химична реакция



