Реакцията на окисление-редукция се характеризира като едновременен процес на загуба и печалба на електрони, тъй като електроните, загубени от атом, йон или молекула, веднага се получават от други.
За да разберете, вижте пример:
Разтвор на меден сулфат (CuSO4 (aq)) е синьо поради наличието на Cu йон2+ разтворени в него. Ако поставим метална цинкова плоча (Zn(с)) в този разтвор с течение на времето можем да забележим две промени: цветът на разтвора ще стане безцветен и върху цинковата плоча ще се появи метална медна утайка.
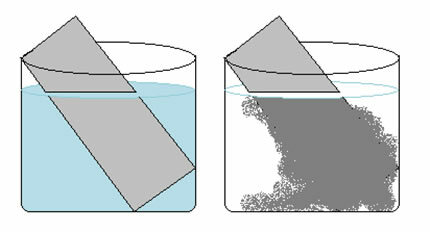
Следователно реакцията, която възниква в този случай, е следната:
Zn(с) + CuSO4 (aq) → Cu(с) + ZnSO4 (aq)
или
Zn(с) + Cu2+(тук) + ОС42-(тук) → Cu(с) + Zn2+(тук) + ОС42-(тук)
или все пак
Zn(с) + Cu2+(тук) → Cu(с) + Zn2+(тук)
Имайте предвид, че е имало трансфер на електрони от цинк към мед. Анализирайки изолирано трансформацията, настъпила във всеки от тези елементи, имаме:
- Zn(с) → Zn2+(тук)
Цинкът загуби 2 електрона, преминавайки от метален цинк към катион. В този случай, цинкът е претърпял окисление.
- Задник2+(тук) → Cu(с)
С медта се случи обратното, тя спечели 2 електрона, преминавайки от катион на мед II в метална мед. Медта е намалена.
Това обяснява двете наблюдавани промени, тъй като разтворът става безцветен, тъй като медните йони се трансформират в метална мед, която се отлага върху цинковата плоча.
Не спирайте сега... Има още след рекламата;)
Тъй като имаше едновременна загуба и печалба на електрони, тази реакция е пример за редокс реакция, и чрез него можем да установим следните концепции, които се повтарят за всички други реакции на това Тип:

Най-реактивният метал претърпява окисляванеПо този начин в предложения пример цинкът е по-реактивен от медта.
Друга окислително-редукционна реакция, която може да бъде цитирана, възниква, когато поставим магнезий или алуминий в разтвор на солна киселина. В тези реакции водородът от солна киселина получава 3 електрона от алуминий (или 2 електрона от магнезий), като го предава от катиона Н+ за водороден газ (H2), докато металът се превръща в катион:
2 Ал(с) + 6 Н+(тук) → 2 Al3+(тук) + 3Н2 (g)
mg(с) + 2 Н+(тук) → Mg2+(тук) + Н2 (g)
Металите се подлагат на окисление, а водородът - на редукция. По-долу е фигура, която показва, че добавянето на магнезий към солна киселина причинява a ефервесценция, която се дължи на отделянето на водороден газ и магнезият изчезва, както е консумирани.
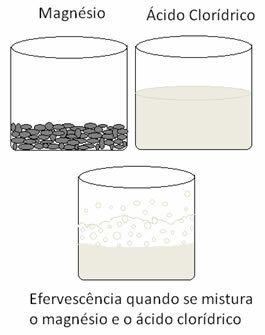
От Дженифър Фогаса
Завършва химия
Искате ли да се позовавате на този текст в училище или академична работа? Виж:
FOGAÇA, Дженифър Роча Варгас. "Окислителни реакции"; Бразилско училище. Наличен в: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao.htm. Достъп на 28 юни 2021 г.
Химия
Работа с въздушна възглавница, устройство, предназначено за защита на водачите, електрически импулс, реакция на химическо разлагане, сблъсък, химическа смес от натриев азид, сензори, разположени върху бронята на автомобила, алкален силикат, газ азот.
Химия

Фоточувствителни лещи, окислително-редукционни реакции, загуба или печалба на електрони, фотосинтетични лещи в слънчеви очила, състав на фотохроматично стъкло, тетраедрични кислородни атоми, кристална структура на сребърен хлорид, ултравиолетова светлина, сребърен метал



