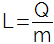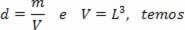พลังงานภายใน คือผลรวมของ พลังงานจลน์ และศักยภาพที่เกี่ยวข้องกับการเคลื่อนที่ของอะตอมที่เป็นส่วนประกอบและโมเลกุลของร่างกาย พลังงานภายในยังเป็นสัดส่วนโดยตรงกับ อุณหภูมิ ของร่างกาย. เป็นปริมาณสเกลาร์ที่วัดเป็นจูล (SI) และกำหนดเป็นฟังก์ชันของตัวแปรเช่น ความดัน (พี) ปริมาณ (V) และ อุณหภูมิ เทอร์โมไดนามิกส์ (T) ของระบบ หน่วยเป็นเคลวิน (K)
ยิ่งอุณหภูมิของร่างกายสูงขึ้น พลังงานภายในก็จะยิ่งมากขึ้นเท่านั้น ความสามารถในการทำงานก็จะยิ่งมากขึ้นเท่านั้น นอกจากนี้ พลังงานภายในของก๊าซอะตอมเดี่ยว เช่น ถูกกำหนดโดยผลรวมของ พลังงานจลน์ ของแก๊สทุกอะตอม เมื่อต้องรับมือกับก๊าซระดับโมเลกุล เช่น ก๊าซไดอะตอมมิก เราจะต้องคำนึงถึงปฏิสัมพันธ์ของโมเลกุลและสำหรับ นี้พลังงานภายในถูกกำหนดโดยผลรวมของพลังงานจลน์ของโมเลกุลที่มีพลังงานศักย์ที่มีอยู่ระหว่าง พวกเขา
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
พลังงานภายในของก๊าซอะตอมเดียวในอุดมคติ
เนื่องจากไม่มีปฏิสัมพันธ์ระหว่างอะตอมของก๊าซอะตอมเดี่ยวในอุดมคติ พลังงานภายในของมันจึงขึ้นอยู่กับตัวแปรสองตัวเท่านั้น: จำนวนโมล (n) และอุณหภูมิของแก๊ส (T) ดู:

ยู - กำลังภายใน
ไม่ – จำนวนโมล
R – ค่าคงที่สากลของก๊าซสมบูรณ์
ตู่ – อุณหภูมิ
ในสมการข้างต้น R มีโมดูลัส 0.082 atm ลิตร/โมล K หรือ 8.31 จูล/โมล เค (เอสไอ). นอกจากนี้ เราสามารถเขียนสมการข้างต้นในรูปของปริมาณอื่นๆ เช่น ความดันและปริมาตร เพื่อที่เราต้องจำ สมการของ Clapeyron, ใช้สำหรับก๊าซในอุดมคติ

แทนสมการข้างต้นสำหรับสมการก่อนหน้า เราจะมีนิพจน์ต่อไปนี้สำหรับการคำนวณพลังงานภายใน:

ดูยัง:ก๊าซที่สมบูรณ์แบบคืออะไร?
เมื่อพิจารณาสมการข้างต้นแล้ว เป็นไปได้ที่จะกำหนดความสัมพันธ์ระหว่างพลังงานจลน์ของอะตอมของก๊าซโมโนอะตอมมิกในอุดมคติกับอุณหภูมิของมัน สำหรับสิ่งนี้เราจะระบุว่าพลังงานจลน์ของก๊าซประเภทนี้คือ อย่างหมดจดจลนศาสตร์ ดู:

ม - พาสต้า
ไม่ – หมายเลขไฝ
เอ็ม - มวลกราม
ในหลาย ๆ สถานการณ์ เป็นเรื่องที่น่าสนใจที่จะทราบวิธีการคำนวณความแปรผันของพลังงานภายใน (ΔU) ของก๊าซ เนื่องจากปริมาณนี้บ่งชี้ว่าก๊าซ ได้รับแล้ว หรือ ส่งไปให้ พลังงาน. หากความแปรผันของพลังงานภายในของก๊าซเป็นบวก (ΔU > 0) ก๊าซจะได้รับพลังงาน มิฉะนั้น (ΔU< 0) ก๊าซจะสูญเสียพลังงานบางส่วนไป

ความแปรผันของพลังงานภายในในแง่ของการเปลี่ยนแปลงปริมาณก๊าซ
พลังงานภายในสำหรับก๊าซไดอะตอมมิก
สำหรับก๊าซไดอะตอมมิกในอุดมคติ พลังงานภายในถูกกำหนดโดยสมการที่ต่างกันเล็กน้อย

พลังงานภายในในการเปลี่ยนแปลงทางอุณหพลศาสตร์และวัฏจักร
ให้เป็นไปตาม กฎข้อที่ 1 ของอุณหพลศาสตร์, พลังงานภายในของก๊าซในอุดมคติอาจแตกต่างกันไปในบางส่วน การเปลี่ยนแปลงทางอุณหพลศาสตร์ขึ้นอยู่กับปริมาณความร้อนที่แลกเปลี่ยนระหว่างสภาพแวดล้อมและระบบ ตลอดจนงานที่ทำโดยหรือบนระบบ

คิว – ความร้อน
τ - งาน
ต่อไป ลองดูรูปแบบที่กฎหมายนี้ใช้สำหรับการแปลงทางเทอร์โมไดนามิกเฉพาะบางอย่าง
ดูยัง:ประวัติของเครื่องจักรความร้อน
→ พลังงานภายใน: การเปลี่ยนแปลงอุณหภูมิความร้อน
ที่ การเปลี่ยนแปลงอุณหภูมิความร้อนไม่มีการเปลี่ยนแปลงของอุณหภูมิ ดังนั้นพลังงานภายในจึงคงที่

ในกรณีนี้ ปริมาณความร้อนทั้งหมดที่แลกเปลี่ยนกับระบบจะเปลี่ยนเป็นการทำงานและในทางกลับกัน
→ พลังงานภายใน: การเปลี่ยนแปลงไอโซโวลูเมทริก
ที่ การแปลงไอโซโวลูเมทริกไม่สามารถดำเนินการได้ เนื่องจากระบบถูกกักขังอยู่ในภาชนะที่แข็งและขยายไม่ได้ ในกรณีนี้ ปริมาณความร้อนทั้งหมดที่แลกเปลี่ยนกับระบบจะเปลี่ยนพลังงานภายในโดยตรง

→ พลังงานภายใน: การเปลี่ยนแปลงไอโซบาริก
ในการแปลงรูปแบบนี้ ระบบอยู่ภายใต้ a ความดันคงที่ดังนั้นงานที่ทำโดยเขาหรือเขาสามารถคำนวณวิเคราะห์ได้

→ พลังงานภายใน: การเปลี่ยนแปลงแบบอะเดียแบติก
ใน การแปลงแบบอะเดียแบติก, ไม่มีการแลกเปลี่ยนความร้อนระหว่างระบบกับสภาพแวดล้อม ดังนั้นความผันแปรของพลังงานภายในจึงขึ้นอยู่กับงานที่ทำโดยหรือบนระบบเท่านั้น

พลังงานภายในในกระบวนการวัฏจักร
ในทุกกระบวนการวัฏจักร สถานะทางอุณหพลศาสตร์ของระบบ ซึ่งแสดงด้วยตัวแปรความดัน ปริมาตร และอุณหภูมิ (P, V, T) คือ เปลี่ยนรูป แต่กลับคืนสู่สภาพเดิม (P, V, T) ดังนั้นความแปรผันของพลังงานภายในในกระบวนการประเภทนี้จะเป็นโมฆะเสมอ (ΔU = 0).
ดูยัง:การเปลี่ยนแปลงวัฏจักร
ดูกราฟด้านล่าง ซึ่งแสดงการเปลี่ยนแปลงทางเทอร์โมไดนามิกส์ที่แตกต่างกันสามแบบระหว่างสถานะ A และ B

เมื่อการเปลี่ยนแปลงทั้งสาม (I, II และ III) ออกจากสถานะ A และไปที่สถานะ B การแปรผันของพลังงานภายในจะต้องเท่ากันสำหรับการเปลี่ยนแปลงทั้งหมด ดังนั้น:

การออกกำลังกายพลังงานภายใน
1) สองโมลของก๊าซไดอะตอมมิกในอุดมคติซึ่งมีมวลโมลาร์เท่ากับ 24 กรัม/โมล ถูกพบที่อุณหภูมิ 500 K ภายในภาชนะแข็งแบบปิดที่มีปริมาตรเท่ากับ 10-3 ลบ.ม. กำหนด:
ก) โมดูลัสของพลังงานภายในของก๊าซนี้มีหน่วยเป็นจูล
ข) ความดันที่ก๊าซกระทำต่อผนังของภาชนะ
ความละเอียด:
ก) เนื่องจากเป็นก๊าซในอุดมคติและเป็นก๊าซไดอะตอมมิก เราจะใช้สูตรด้านล่างเพื่อคำนวณพลังงานภายใน:

การนำข้อมูลที่แจ้งในคำชี้แจงการฝึกหัด เราจะมีการคำนวณต่อไปนี้เพื่อแก้ไข:

ข) เราสามารถกำหนดความดันที่ก๊าซปล่อยออกมาเมื่อเราทราบปริมาตรของภาชนะ: 10-3 ลบ.ม. ในการทำเช่นนี้เราจะใช้สูตรต่อไปนี้:

By Me. ราฟาเอล เฮเลอร์บร็อก