ข้อความ ปฏิกิริยาเพิ่มเติม แสดงให้เห็นว่าปฏิกิริยาอินทรีย์ประเภทนี้มีชื่อในลักษณะนี้เนื่องจากสารตั้งต้นถูกเติมลงในโมเลกุลอินทรีย์โดยการทำลายพันธะระหว่างคาร์บอน ในข้อความนี้แสดงกรณีของอัลคีน ในที่นี้เราจะพิจารณาว่าสิ่งนี้เกิดขึ้นกับอัลคีนได้อย่างไร หรือ นั่นคือ กับไฮโดรคาร์บอนเหล่านั้น (เกิดจากอะตอมของคาร์บอนและไฮโดรเจนเท่านั้น) ที่มีพันธะ สาม
จุดอ่อนของอัลคีนคือพันธะสามตรง โดยที่พันธะประเภท pi (π) สามารถแตกออกได้หนึ่งพันธะ (เพิ่มเติม บางส่วน) หรือสองครั้ง (การเติมทั้งหมด) และทำให้เกิดสารประกอบใหม่ที่มีพันธะคู่ (แอลคีน) หรือพันธะเดี่ยวตามลำดับ (อัลเคน).
ลองดูกรณีของปฏิกิริยาการเติมในอัลไคน์:
1. การเติมไฮโดรเจนหรือไฮโดรจิเนชัน:
ในกรณีนี้ โมเลกุล H2 ถูกเติมลงในอัลไคน์โดยใช้ตัวเร่งปฏิกิริยา ซึ่งมักจะเป็นผงนิกเกิล (Ni), แพลตตินั่ม (Pt) หรือแพลเลเดียม (Pd) เนื่องจากจำเป็นต้องใช้ตัวเร่งปฏิกิริยา จึงเรียกปฏิกิริยานี้ว่า เร่งปฏิกิริยาไฮโดรจิเนชัน และมันเกิดขึ้นในระยะ: ในระยะแรกคุณจะได้อัลคีน และในระยะที่สอง ซึ่งช้ากว่า คุณจะได้อัลเคน
ถ้าตัวเร่งปฏิกิริยาที่ใช้แรง เช่น นิกเกิลและแพลตตินั่ม ปฏิกิริยาจะสร้างอัลเคนโดยตรง แพลเลเดียมผสมกับ BaSO
4 มันเป็นตัวเร่งปฏิกิริยาที่อ่อนแอและผลิตอัลคีน นอกจากนี้ยังสามารถใช้ตัวยับยั้งการเร่งปฏิกิริยาบางส่วนเพื่อเข้าถึงอัลคีนเท่านั้น ปฏิกิริยานี้เกิดขึ้นภายใต้แรงกดดันและอุณหภูมิสูงเช่นกันต่อไป เรามีการเติมไฮโดรเจนลงในอีเทน การผลิตเอทิลีน และอีเทน:

2. การเติมฮาโลเจนหรือฮาโลเจน:
พันธะ pi ของอัลไคน์แตกและอะตอมของฮาโลเจนสองอะตอมถูกเติมลงในโมเลกุล (องค์ประกอบจากตระกูล 17A ของตารางธาตุซึ่งใช้มากที่สุดคือ: Cl2 และ Br2) ก่อตัวเป็นไดฮาไลด์ในช่องปาก หมายความว่าอะตอมของฮาโลเจนสองอะตอมถูกผูกมัดกับอะตอมของคาร์บอนที่อยู่ใกล้เคียง ปฏิกิริยาสามารถดำเนินต่อไป ทำลายพันธะ pi อื่นและเพิ่มอะตอมของฮาโลเจนอีกสองอะตอมให้กับโมเลกุล
ในตัวอย่างด้านล่าง เรามีการเพิ่มเติมประเภทของสินบนนี้:
ClCl ClCl
││ ││
เอช ─C ≡ C CH3 + Cl2 → H ─ C ═ C CH3 + Cl2 → H ─ C ─ C CH3
││
ClCl
อัลซิโน ได-ฮาเล็ตเตตระฮาเลตต์LE
3. การเติมไฮโดรเจนเฮไลด์ (ฮาโลเจนไฮไดรด์หรือไฮโดรฮาโลจิเนชัน):
ที่นี่เติมไฮโดรเจนเฮไลด์ลงในอัลไคน์และสามารถเติมบางส่วนและทั้งหมดได้เช่นกัน ลักษณะสำคัญของปฏิกิริยาประเภทนี้คือมันเป็นไปตาม กฎของมาร์คอฟนิคอฟกล่าวคือ ไฮโดรเจนจับกับคาร์บอนที่เติมไฮโดรเจนมากขึ้น (โดยมีอะตอมไฮโดรเจนติดอยู่มากกว่า) และฮาโลเจนจับกับคาร์บอนที่เติมไฮโดรเจนน้อยกว่า
ในไฮโดรฮาโลจิเนชันทั้งหมด จะเกิดเจมิกไดฮาไลด์ กล่าวคือ สารประกอบที่มีอะตอมของฮาโลเจนสองอะตอมติดอยู่กับคาร์บอนเดียวกัน
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
ดู:
โฮBr Hbr
││ ││
เอช ─C ≡ C CH3 + HBr → H ─ C ═ C CH3 + HBr → H ─ C ─ C CH3
││
โฮbr
ALCINO HALIDE GEMIC DI-HALOGIDE
ตัวอย่างที่สำคัญของปฏิกิริยาประเภทนี้คือปฏิกิริยาที่เกิดขึ้นเมื่อเติมไฮโดรเจนคลอไรด์ลงในเอไทน์ ก่อตัวเป็น คลอโรเอธินหรือไวนิลโมโนคลอไรด์ซึ่งเป็นโมโนเมอร์ที่สร้างพอลิไวนิลคลอไรด์พอลิเมอร์รู้จักกันดีโดยใช้ตัวย่อ พีวีซี
โฮClHCl
││ ││
เอช ─C ≡ C ─ H + HCl → H ─ C ═ C ─ H + HCl → H ─ C ─ ค ─ โฮ
││
โฮCl
เอทิโนคลอรีน 1,1-DICHLOROETHANE
(พีวีซีโมโนเมอร์)
พีวีซีเป็นสารที่ใช้กันอย่างแพร่หลายในอุตสาหกรรมสำหรับการผลิตผลิตภัณฑ์ต่างๆ เช่น รองเท้าแตะ ขวดยา อุปกรณ์ทางการแพทย์ กางเกงพลาสติกสำหรับทารก กระเป๋า เคลือบลวด, ของเล่น, เบาะเฟอร์นิเจอร์, เบาะรถยนต์, เสื้อกันฝน, รองเท้าพลาสติก, แผ่นเสียงไวนิล, พื้น, ฟิล์มบรรจุภัณฑ์, ท่อที่ใช้ในท่อน้ำ และน้ำเสียเป็นต้น
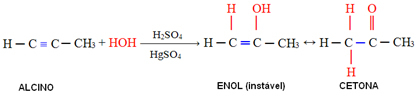
4. การเติมน้ำ (การให้น้ำ):
ในปฏิกิริยานี้ น้ำทำปฏิกิริยากับอัลไคน์ โดยเริ่มก่อตัวเป็นอีนอล ซึ่งผ่านการจัดเรียงโมเลกุลใหม่และเปลี่ยนเป็นอัลดีไฮด์ (ในกรณีของอัลไคน์ที่มีขนาดเล็กกว่าอะเซทิลีน) Enol และ aldehyde ยังคงอยู่ในสมดุลไดนามิกที่มีความเหนือกว่าอัลดีไฮด์ นี่เป็นกรณีของ Dynamic Constitucikonal Isomery หรือ Tautomery.
ตัวอย่าง:

ในกรณีของอัลคีนที่มีขนาดใหญ่กว่าอะเซทิลีน กฎของ Markovnikov จะปฏิบัติตามและ enol จะทำให้เกิดคีโตน:
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี

