โมลาลิตี้ เป็นรูปแบบของความเข้มข้นของ โซลูชั่น (ชอบ ความเข้มข้นทั่วไป, ความเข้มข้นเป็นโมล/L, ชื่อมวลชน mass) ใช้เพื่อกำหนดความสัมพันธ์ระหว่างปริมาณในโมลของตัวถูกละลายในมวลตัวทำละลายที่กำหนด
สัญลักษณ์ที่ใช้แทน ศีลธรรม คือ W; โอ ไฝ ของตัวถูกละลายแสดงโดย n1; และมวลของตัวทำละลายมีสัญลักษณ์เป็น m2. ดังนั้น ด้วยสัญลักษณ์เหล่านี้ เราจึงสามารถสร้างนิพจน์ทางคณิตศาสตร์โดยใช้คำจำกัดความที่เสนอสำหรับโมลาลิตี:
ว = ไม่1
ม2
ความสัมพันธ์นี้แสดงทางคณิตศาสตร์โดยการหาร ดังนั้น ศีลธรรม เป็นรูปแบบของความเข้มข้นที่เกี่ยวข้องกับการหารจำนวนโมลของตัวถูกละลายด้วยมวลของตัวทำละลาย
เป็นที่น่าสังเกตว่าจำนวนโมลของตัวถูกละลายมีนิพจน์ทางคณิตศาสตร์เฉพาะ เนื่องจากเป็นความสัมพันธ์ระหว่างมวลของตัวถูกละลาย (m1) ที่มีอยู่ในสารละลายและ มวลกราม ของตัวถูกละลายนี้ (M1):
ไม่1 = ม1
เอ็ม1
จากนั้น เราสามารถเชื่อมโยงสูตรสำหรับจำนวนโมลของตัวถูกละลายกับสูตรสำหรับ ศีลธรรมส่งผลให้นิพจน์ต่อไปนี้:
ว = ม1
เอ็ม1.m2
โดยไม่คำนึงถึงสูตรที่ใช้ ไม่ว่าจะเกี่ยวข้องกับสูตรเลขโมลหรือไม่ก็ตาม หน่วยวัดที่ใช้ต้องเป็นโมล/กก. หรือโมลาล ดังนั้นจึงเป็นสิ่งสำคัญที่จะต้องสังเกตข้อมูลด้วยหน่วยต่อไปนี้:
มวลของตัวถูกละลาย (m1): กรัม (ก.)
มวลโมลของตัวถูกละลาย (M1): กรัมต่อโมล (g/mol)
จำนวนโมลของตัวถูกละลาย (n1): โมล
มวลตัวทำละลาย (m2): กิโลกรัม (กก.).
ด้านล่างนี้เป็นตัวอย่างบางส่วนของแบบฝึกหัดเกี่ยวกับ ศีลธรรม:
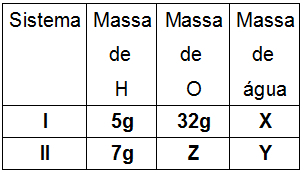
ตัวอย่างที่ 1 - (ITA-SP) ฉลากบนขวดระบุว่ามีสารละลาย LiNO 1.50 โมลาล3 ในเอทานอล ซึ่งหมายความว่าโซลูชันประกอบด้วย:
ก) LiNO. 1.50 โมล3/กิโลกรัมของสารละลาย
b) LiNO. 1.50 โมล3/ลิตรของสารละลาย
c) LiNO. 1.50 โมล3/กิโลกรัมเอทานอล
d) LiNO. 1.50 โมล3/ลิตรเอทานอล
จ) 1.50 โมลของ LiNO3/โมลของเอทานอล
ในแบบฝึกหัดนี้ เราควรจะทำการวิเคราะห์เชิงทฤษฎีเท่านั้น เนื่องจากจะรายงานโมลาลิตี (1.5 โมลของ LiNO3 ในเอทานอล) และขอองค์ประกอบของสารละลาย เรารู้ว่าโมลาลิตีเป็นความสัมพันธ์ระหว่างจำนวนโมลของตัวถูกละลาย (LiNO3) และมวลของตัวทำละลาย (เอทานอล) และคำว่าโมลสามารถถูกแทนที่ด้วยโมล/กก. ดังนั้นเราจึงนำเสนอในการแก้ปัญหา (ทางเลือก c):
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
LiNO. 1.5 โมล3;
เอทานอล 1 กก.
ตัวอย่างที่ 2 - (UFF-RJ-Adapted) กลูโคส โดยมีสูตรโครงสร้าง C6โฮ12โอ6เป็นน้ำตาลธรรมดาและยังเป็นแหล่งพลังงานหลักของมนุษย์และสัตว์มีกระดูกสันหลังอื่นๆ น้ำตาลที่ซับซ้อนมากขึ้นสามารถเปลี่ยนเป็นกลูโคสได้ ในชุดของปฏิกิริยา กลูโคสจะรวมตัวกับออกซิเจนที่เราหายใจเข้าไปและผลิตออกมา หลังจากสารประกอบขั้นกลางจำนวนมาก คาร์บอนไดออกไซด์และน้ำด้วยการปลดปล่อยพลังงาน การให้อาหารทางหลอดเลือดดำในโรงพยาบาลมักประกอบด้วยสารละลายน้ำตาลกลูโคสในน้ำโดยเติมเกลือแร่ สมมติว่ากลูโคส 1.50 กรัมละลายในน้ำ 64.0 กรัม สารละลายที่ได้จะเป็นโมลาลิตีเท่าใด
ก) 0.13
ข) 0.20
ค) 0.40
ง) 0.31
จ) 0.41
ข้อมูลที่จัดทำโดยการฝึกหัดคือ:
มวลของตัวถูกละลาย (m1): 1.5 กรัม
มวลตัวทำละลาย (m2): 64 กรัม
สูตรโมเลกุลของตัวถูกละลาย: C6โฮ12โอ6
การพิจารณาโมลาลิตีของสารละลาย น่าสนใจที่จะดำเนินการตามขั้นตอนต่อไปนี้:
ขั้นตอนที่ 1: เปลี่ยนมวลตัวทำละลายจาก g เป็น kg
ในการทำเช่นนี้ เพียงหารมวลที่ให้มา 64 ก. ด้วย 1,000 ซึ่งได้ผลลัพธ์เป็น 0.064 กก.
ขั้นตอนที่ 2: หามวลโมลาร์ของตัวถูกละลาย
สำหรับสิ่งนี้ เราต้องคูณจำนวนอะตอมของธาตุในสูตรโมเลกุลด้วยมวลอะตอมของมัน (มีอยู่ในตารางธาตุ) แล้วจึงบวกผลลัพธ์:
เอ็ม1 = 6.มวลของ C + 12 มวลของ H + 6. มวลของ O
เอ็ม1= 6.12 + 12.1 + 6.16
เอ็ม1 = 72 + 12 + 96
เอ็ม1 = 180 กรัม/โมล
ขั้นตอนที่ 3: ใช้ข้อมูลที่ให้และพบในขั้นตอนก่อนหน้าในนิพจน์ต่อไปนี้:
ว = ม1
เอ็ม1.m2
ว = 1,5
180.0,064
ว = 1,5
11,52
W = 0.13 โมล (โดยประมาณ)
By Me. ดิโอโก้ โลเปส ดิอาส