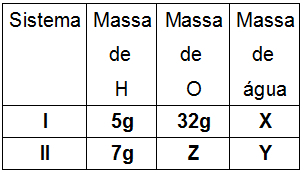
ความเข้มข้นของสสารเป็นวิธีการหาปริมาณตัวถูกละลายและไอออนของตัวถูกละลายในสารละลาย รูปแบบของความเข้มข้นนี้ แสดงรายการจำนวนโมลของตัวถูกละลายและปริมาตรของสารละลายทั้งหมด:
ม = ไม่1
วี
M = ความเข้มข้นในปริมาณของสสาร
ไม่1 = จำนวนโมลของตัวถูกละลาย
V = ปริมาตรของสารละลาย
อย่างไรก็ตาม ปริมาณของตัวถูกละลาย สามารถคำนวณได้เฉพาะโดยใช้เครื่องหมาย การแบ่งมวลของตัวถูกละลาย (m1) โดยมวลโมลาร์ของมัน (M1). ความสัมพันธ์นี้สามารถเห็นได้ในสูตรด้านล่าง:
ไม่1 = ม1
เอ็ม1
ด้วยวิธีนี้ เมื่อรู้สูตรสำหรับความเข้มข้นของปริมาณสสารและสูตรสำหรับปริมาณของสสาร เราสามารถเชื่อมโยงทั้งสองได้โดยการแทนที่ n1 โดยความสัมพันธ์ m1/M1 ทางนี้:
ม = ม1
เอ็ม1.V
สูตรนี้จะใช้เมื่อใดก็ตามที่การออกกำลังกายให้มวลของตัวถูกละลาย (m1), และไม่ใช่ปริมาณของสารที่มีอยู่ในสารละลาย
ว่าด้วยหน่วยวัดเราต้องใช้ mo/L สำหรับความเข้มข้นของปริมาณสสาร โดยกำหนดให้หน่วย ใช้สำหรับจำนวนโมลของตัวถูกละลายคือโมลและหน่วยที่ใช้สำหรับปริมาตรของสารละลายคือ ลิตร (L). นอกจากนี้ยังสามารถใช้หน่วยโมลาร์หรือหน่วย M แทนโมล/ลิตร
ติดตาม สองตัวอย่างสูตรความเข้มข้นของปริมาณสสาร:
ตัวอย่างที่ 1: คำนวณความเข้มข้นในปริมาณสสารของสารละลายที่มี Na. 0.6 โมล2เท่านั้น4 ในสารละลาย 400 มล.
ข้อมูลการออกกำลังกาย:
ม = ?
ไม่1 = 0.6 โมล
วี = 400 มล. อย่างไรก็ตาม ปริมาตรต้องทำงานในหน่วยลิตร ในการดำเนินการนี้ ให้หารค่าที่ระบุด้วย 100 ดังนั้น V = 0.4 L.
ตอนนี้เราใช้ค่าที่ระบุในการแสดงออกของความเข้มข้นในปริมาณของสสาร:
ม = ไม่1
วี
ม = 0,6
0,4
M = 1.5 โมล/ลิตร
ตัวอย่างที่ 2: โซเดียมซัลเฟตมีมวลเท่าใด (Na2เท่านั้น4) ซึ่งจะต้องละลายในน้ำเพื่อให้ได้ปริมาตรของสารละลาย 500 มล. เพื่อให้ได้สารละลาย 0.03 โมลต่อลิตร
ข้อมูลการออกกำลังกาย:
ม1 = ?
วี = 500 มล. หารด้วย 1,000 เราได้ 0.5 ลิตร
M = 0.03 โมล/ลิตร
การหามวลโมลาร์ของตัวถูกละลายในแบบฝึกหัด ให้คูณค่ามวลของแต่ละธาตุด้วยจำนวนอะตอมในสูตรตัวถูกละลาย Na2เท่านั้น4และเพิ่มผลลัพธ์:
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
สำหรับนา เรามี:
2.23 = 46 กรัม/โมล
สำหรับ S เรามี:
1.32 = 32 กรัม/โมล
สำหรับ O เรามี:
4.16 = 64 กรัม/โมล
ตอนนี้เราเพิ่มผลลัพธ์ที่พบสำหรับแต่ละองค์ประกอบ:
เอ็ม1 = 46 + 32 + 64
เอ็ม1 = 142 กรัม/โมล
ด้วยข้อมูลเหล่านี้ เราสามารถกำหนดค่ามวลของตัวถูกละลายได้ (m1) ผ่านสูตรความเข้มข้นในปริมาณของสสาร:
ม = ม1
เอ็ม1.V
0,03 = ม1
142.0,5
0,03 = ม1
71
ม1 = 0,03.71
ม1 = 2.13 ก.
ความเข้มข้นของปริมาณไอออนสสาร
เพื่อหาความเข้มข้นของปริมาณไอออนที่อ้างถึงตัวถูกละลายในสารละลาย ก็เพียงพอแล้วที่จะทราบความเข้มข้นของปริมาณสสารของตัวถูกละลายในสารละลาย ดูตัวอย่างบางส่วน:
ตัวอย่างที่ 1: หาความเข้มข้นของธาตุแมกนีเซียมไอออน (Mg+2) และคลอรีน (Cl-) นำเสนอในสารละลายที่เตรียมโดยการละลาย MgCl. 50 กรัม2 ในน้ำซึ่งส่งผลให้มีสารละลาย 800 มล. ข้อมูล: (มวลโมลาร์: Mg = 24g/mol, Cl = 35 g/mol)
ข้อมูลการออกกำลังกาย:
ม1 = 50 กรัม
วี = 800 มล. หารด้วย 1,000 เราได้ 0.8 ลิตร
การหามวลโมลาร์ของตัวถูกละลายในแบบฝึกหัด ให้คูณค่ามวลของธาตุแต่ละตัวด้วยจำนวนอะตอมในสูตรตัวถูกละลาย, MgCl2และเพิ่มผลลัพธ์:
สำหรับ Mg เรามี:
Mg = 1.24 = 24g/mol
สำหรับ Cl เรามี:
Cl2 = 2.35.5 = 71g/โมล
การเพิ่มผลลัพธ์ที่พบสำหรับแต่ละองค์ประกอบ เรามี:
เอ็ม1 = 24 +71
เอ็ม1 = 95 กรัม/โมล
ก่อนกำหนดความเข้มข้นในปริมาณของสสารของแต่ละไอออน เราต้องหาความเข้มข้นของปริมาณของสสารในสารละลายก่อน
ม = ม1
เอ็ม1.V
ม = 50
95.0,8
ม = 50
76
M = 0.65 โมล/ลิตร
ตอนนี้ รู้ความเข้มข้นของสารละลายทั้งหมด เพียงคูณด้วยปริมาณไอออนในสูตรเพื่อหาความเข้มข้น:
สำหรับแมกนีเซียมไอออนบวก (Mg+2):
[Mg+2] = 1. 0,65
[Mg+2] = 0.65 โมล/ลิตร
สำหรับคลอไรด์ (Cl-)
[Cl-1] = 2. 0,65
[Cl-1] = 1.30 โมล/ลิตร
By Me. Diogo Lopes Dias
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
DAYS ดิโอโก้ โลเปส "ความเข้มข้นของสสารคืออะไร"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-concentracao-quantidade-materia.htm. เข้าถึงเมื่อ 28 มิถุนายน 2021.
เคมีคืออะไร?

ทำความเข้าใจว่า Kp คืออะไร ค่าคงที่สมดุลในแง่ของความดัน และรู้วิธีหาค่ามันโดยใช้แรงกด บางส่วนของก๊าซทั้งหมดที่มีอยู่ในสมดุลเคมี ซึ่งสามารถอยู่ในบรรยากาศ (atm) หรือมิลลิเมตรของปรอท (มม.ปรอท). คลิกที่นี่และหาข้อมูลเพิ่มเติมเกี่ยวกับเรื่องนี้!
โซลูชั่น โซลูชั่นที่เป็นของแข็ง สารละลายของเหลว สารละลายแก๊ส สารละลายที่เกิดจากแก๊สและของเหลว สารละลายที่เกิดจากของเหลว