ความร้อนแฝง คือปริมาณของ พลังงานความร้อน ที่ร่างกายหรือระบบอุณหพลศาสตร์ดูดซับหรือลดทอนลง ในระหว่างที่สภาวะทางกายภาพเปลี่ยนแปลงไป ใน อุณหภูมิคงที่
เมื่อสารบริสุทธิ์ถึงอุณหภูมิของ ฟิวชั่น หรือ เดือดในระหว่างการวอร์มอัพ สภาพร่างกายของคุณเริ่มเปลี่ยนแปลง ในกระบวนการนี้ มันยังคงดูดซับความร้อน อย่างไรก็ตาม มัน อุณหภูมิซากค่าคงที่ สิ่งนี้เกิดขึ้นเพราะเมื่อถึงอุณหภูมิเหล่านี้ซึ่งการเปลี่ยนแปลงสถานะทางกายภาพเกิดขึ้น ความร้อนทั้งหมดที่ถูกดูดซับโดยระบบเทอร์โมไดนามิกจะถูกใช้เพื่อเอาชนะ พลังงานศักยภาพ ที่รวมโมเลกุลไว้ด้วยกัน ทันทีที่ระบบเทอร์โมไดนามิกส์ดูดซับพลังงานทั้งหมดที่จำเป็นในการสลายโมเลกุล ปฏิกิริยาระหว่างพวกมันก็ลดลง ซึ่งบ่งชี้ว่าสถานะของการรวมตัวของพวกมันเปลี่ยนไป หลังการเปลี่ยนแปลงสภาพร่างกาย ความร้อนที่ถูกดูดกลืน isothermally ยังคงถูกดูดซับโดยโมเลกุลโดยให้พวกมัน พลังงานจลนศาสตร์. ความร้อนชนิดนี้ที่เพิ่มพลังงานจลน์ของโมเลกุลเรียกว่า ความร้อนที่เหมาะสม.
ดูยัง: เคล็ดลับ “ทองคำ” 7 ข้อเพื่อการศึกษาฟิสิกส์ที่มีประสิทธิภาพยิ่งขึ้น
โอ ความร้อนแฝง วัดปริมาณความร้อนต่อหน่วยมวลที่จำเป็นสำหรับการเปลี่ยนแปลงใด ๆ ใน สภาพร่างกายจึงเป็นหน่วยวัดตามระบบสากล (SI) คือ Jouleต่อกิโลกรัม (เจ/กก.). อย่างไรก็ตาม การใช้หน่วยอื่นๆ เช่น แคลอรี่ต่อกรัม (cal/g) เป็นเรื่องปกติในการศึกษาการวัดปริมาณความร้อน
ประเภทของความร้อนแฝง
ความร้อนมีสองประเภท: o ความร้อนถ้าระดับ มันเป็น ความร้อนแฝง. ความร้อนที่เหมาะสมคือสิ่งที่ถ่ายโอนระหว่างร่างกายเมื่อมีการเปลี่ยนแปลงของอุณหภูมิ ความร้อนแฝงจะเกิดขึ้นเมื่อมีการถ่ายเทความร้อนโดยไม่มีการเปลี่ยนแปลงของอุณหภูมิ
ความร้อนแฝงจะเปลี่ยนแปลงตามการเปลี่ยนแปลงในสถานะทางกายภาพที่แตกต่างกัน ตรวจสอบความร้อนแฝงประเภทต่างๆ:
ความร้อนแฝงในการควบรวมกิจการ (LF): มันคือความร้อนที่ร่างกายดูดซับหรือปลดปล่อยในระหว่างกระบวนการหลอมรวม: จากของเหลวเป็นของแข็งและในทางกลับกันด้วยอุณหภูมิคงที่
ความร้อนแฝงในการกลายเป็นไอ (Lวี): เป็นสิ่งที่ถูกถ่ายโอนระหว่างการแปลงของแข็ง-ของเหลวหรือของเหลว-ของแข็ง ใน อุณหภูมิคงที่
ดูยัง: ความจุความร้อนคืออะไร?
ตัวอย่างในความร้อนแฝง
ตรวจสอบสถานการณ์ในชีวิตประจำวันที่มีการแลกเปลี่ยนความร้อนแฝง:
เมื่อเราให้ความร้อนกับน้ำ จนถึงอุณหภูมิ 100°C น้ำจะเริ่มกระบวนการระเหย ตราบใดที่น้ำทั้งหมดไม่กลายเป็นไอ อุณหภูมิของน้ำก็ไม่เปลี่ยนแปลง
เมื่อเราเทน้ำลงบนพื้นผิวที่ร้อนจัด น้ำทั้งหมดจะระเหยกลายเป็นไอแทบจะในทันที กระบวนการนี้เรียกว่าการให้ความร้อนและเกี่ยวข้องกับการดูดซับความร้อนแฝง
มีการแลกเปลี่ยนความร้อนแฝงเมื่อเราสัมผัสขวดโซดาที่อุณหภูมิต่ำและเนื้อหาทั้งหมด แข็งตัวอย่างรวดเร็วที่อุณหภูมิคงที่ เนื่องจากอุณหภูมิต่ำกว่าจุดหลอมเหลวของน้ำ
สูตรความร้อนแฝง
ความร้อนแฝงคำนวณโดยอัตราส่วนของปริมาณความร้อนที่ถ่ายเทในการแปลงสภาพอุณหภูมิความร้อน:
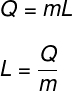
Q – ปริมาณความร้อนที่ถ่ายเท
ม - มวลร่างกาย
หลี่ – ความร้อนแฝง
การเปลี่ยนแปลงเฟสและความร้อนแฝง
การเปลี่ยนแปลงเฟสของสารบริสุทธิ์เกิดขึ้น ในอุณหภูมิค่าคงที่โดยการดูดซับหรือปล่อยความร้อนแฝง สารบริสุทธิ์ทั้งหมดมี a เส้นโค้งความร้อน คล้ายกับภาพด้านล่าง:
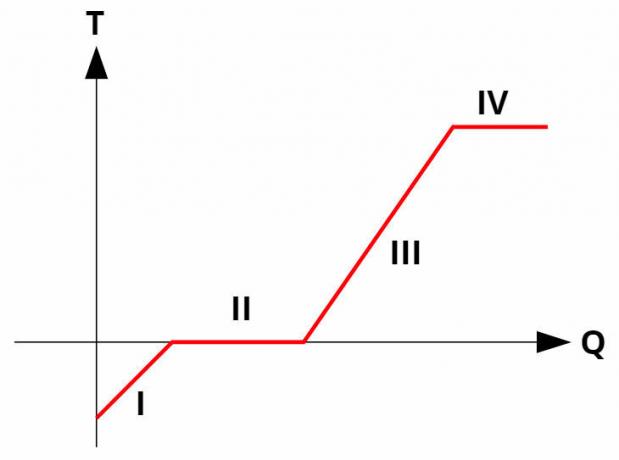
ที่ เส้นโค้งในเครื่องทำความร้อน สัมพันธ์กับอุณหภูมิ (แกน y) กับปริมาณความร้อนที่ได้รับหรือให้ (แกน x) ในการเปลี่ยนแปลงเฟส (กระบวนการ II และ IV) อุณหภูมิจะคงที่แม้ว่าจะยังมีการแลกเปลี่ยนความร้อนอยู่ก็ตาม
ดูด้วย: พื้นฐานของการวัดปริมาณความร้อน
ตารางความร้อนแฝง
ภายใต้สภาวะปกติของ อุณหภูมิ และ ความดัน, O ความร้อนแฝง ของน้ำสำหรับการเปลี่ยนแปลงที่แตกต่างกันในสภาพร่างกายดังแสดงในตารางด้านล่าง:
การแปลงร่าง |
ความร้อนแฝง (cal/g) |
ฟิวชั่น (0°C) |
80 |
การแข็งตัว (0°C) |
-80 |
การกลายเป็นไอ (100 องศาเซลเซียส) |
540 |
การควบแน่น (100 องศาเซลเซียส) |
-540 |
ตามตารางด้านบนนี้ 80แคลอรี่ แช่แข็ง 1 กรัมของน้ำที่อุณหภูมิหลอมเหลว (0 °C) สัญญาณลบใน กระบวนการของ การแข็งตัว และ การควบแน่น แสดงว่าความร้อนถูกปลดปล่อยออกมา ดังนั้นการเปลี่ยนแปลงทั้งสองนี้จึงเป็น คายความร้อน. ตารางด้านล่างแสดงค่าความร้อนแฝงใน เจ/กก.สำหรับกระบวนการเดียวกัน:
การแปลงร่าง |
ความร้อนแฝง (J/กก.) |
ฟิวชั่น (0°C) |
333.103 |
การแข็งตัว (0°C) |
-333.103 |
การกลายเป็นไอ (100 องศาเซลเซียส) |
2,2.106 |
การควบแน่น (100 องศาเซลเซียส) |
-2,2.106 |

แบบฝึกหัดความร้อนแฝง
1) ภาชนะหนึ่งบรรจุน้ำของเหลว 500 กรัม โดยไม่มีการเปลี่ยนแปลงของอุณหภูมิของน้ำ เนื้อหาทั้งหมดจะระเหยไปในทันที กำหนดปริมาณความร้อนที่ถ่ายเทไปยังเนื้อหาของภาชนะนี้
ข้อมูล: LF = 540 แคลอรี/กรัม
ความละเอียด:
ในการคำนวณปริมาณความร้อนที่จำเป็นในการระเหยมวลของน้ำ เราจะใช้สูตรต่อไปนี้:
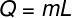
โดยใช้ข้อมูลที่ได้จากการฝึกหัด เราจะทำการคำนวณดังต่อไปนี้:
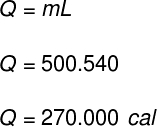
By Me. ราฟาเอล เฮเลอร์บร็อก
