ไฮโดรจีเนชันเกิดขึ้นกับอะไซคลิกไฮโดรคาร์บอนที่ไม่อิ่มตัว กล่าวคือ ซึ่งมีสายโซ่เปิดที่มีพันธะสองหรือสามพันธะ เช่น แอลคีน อัลคีน และไดอีน นอกจากนี้ยังสามารถเกิดขึ้นได้ในอะโรมาติกไฮโดรคาร์บอน เนื่องจากมีพันธะคู่ในวงแหวน และกับไซแคน (ไซโคลอัลเคน) ที่มีคาร์บอนมากถึงห้าตัว
สารประกอบเหล่านี้ทำปฏิกิริยาเหมือนก๊าซไฮโดรเจนเมื่อมีตัวเร่งปฏิกิริยา เช่น นิกเกิล แพลตตินั่ม และแพลเลเดียม ภายใต้การให้ความร้อน ดังนั้น ปฏิกิริยาการเติมจึงเกิดขึ้น ซึ่งพันธะ pi (π) แตกออก ทำให้เกิดพันธะเดี่ยวใหม่สองพันธะ และไฮโดรเจนถูกนำเข้าสู่โมเลกุล
โดยทั่วไป เรามี:
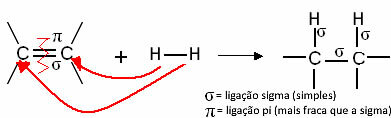
ปฏิกิริยาไฮโดรจิเนชันทั่วไป
ตอนนี้มาดูตัวอย่างบางส่วน:
- ไฮโดรจีเนชันเป็นแอลคีน: ผลิตภัณฑ์ที่ได้รับคืออัลเคน
ด้านล่างเรามีปฏิกิริยาไฮโดรจิเนชันของเอทิลีน (หรือเอทิลีน) เพื่อให้ได้อีเทน:
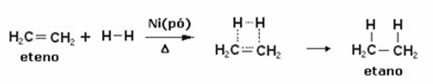
ตัวอย่างปฏิกิริยาเอทิลีนไฮโดรจิเนชัน
อุตสาหกรรมอาหารใช้ Catalytic Hydrogenation ประเภทนี้ในการผลิตไขมันกึ่งของแข็ง เช่น มาการีน. น้ำมันพืชและไขมันต่างกันตรงที่น้ำมันมีโมเลกุลยาว ด้วยพันธะคู่ระหว่างคาร์บอน ในขณะที่ไขมันมีพันธะเดี่ยวระหว่างพวกมัน คาร์บอน
ดังนั้นการเปลี่ยนน้ำมันให้เป็นไขมันก็เพียงพอแล้วที่จะเติมไฮโดรเจนในน้ำมัน ด้วยวิธีนี้ พันธะคู่ของคุณจะถูกทำลายและแปลงเป็นพันธะเดี่ยว ผลที่ได้คือการผลิตการโทร
ไขมันพืชเติมไฮโดรเจน.- ไฮโดรจิเนชันของอัลไคน์: เนื่องจากอัลไคน์มีพันธะ pi สองพันธะ ไฮโดรจิเนชันที่สมบูรณ์ของพวกมันจึงเกิดขึ้นในสองขั้นตอน ในขั้นแรกจะเกิดอัลคีนและในขั้นที่สองคืออัลเคน
ในปฏิกิริยาด้านล่าง เรามีไฮโดรจิเนชันของโพรพีนกับการเกิดโพรเพนขั้นสุดท้าย:
ขั้นตอนที่ 1: โฮ3ซี ซี ≡ CH+ โฮ2 → ฮ3ซี ซีโฮ═ คโฮ2
ขั้นตอนที่ 2: โฮ3ซี ซีโฮ═ คโฮ2 + 2 ชั่วโมง2 → ฮ3ซี ซีโฮ2─ คโฮ3
ถ้าเราต้องการให้ปฏิกิริยานี้หยุดในขั้นตอนที่ 1 เราต้องใช้สารบางอย่างที่หยุดการกระทำของตัวเร่งปฏิกิริยา
- ไฮโดรจิเนชันของ dienes: ไดอีนมีสามประเภท: สะสม (พันธะคู่ปรากฏด้านล่าง) โดดเดี่ยว (พันธะคู่คั่นด้วยพันธะเดี่ยวอย่างน้อยสองตัว) และ คอนจูเกต (พันธะคู่ปรากฏขึ้นสลับกัน)
ไฮโดรจิเนชันของไดอีนสะสมและไดอีนที่แยกออกมานั้นเกิดขึ้นในลักษณะเดียวกับที่เราเห็นสำหรับแอลคีน อย่างไรก็ตาม เพิ่มขึ้นเป็นสองเท่า เนื่องจากไดอีนมีความไม่อิ่มตัวมากกว่า ดูสองตัวอย่าง:
* ตัวอย่างการเติมไฮโดรเจนในไดอีนสะสม:
H H H
│ │ │
โฮ3C CH ═ ค ═ CH CH3 + 2 ชั่วโมง2 → ฮ3C CH ─ ค ─ CH CH3
│ │ │
H H H
* ตัวอย่างการเติมไฮโดรเจนในไดอีนที่แยกได้:
H H H H
│ │ │ │
โฮ3C CH ═ CH─CH2 CH ═ CH CH3 +2 ฮ2 → ฮ3C CH ─ CH─CH2 CH ─ CH CH3
ในทางกลับกัน การเติมไฮโดรเจนของไดอีนคอนจูเกตสามารถเกิดขึ้นได้สองวิธี: ด้วยการเติม 1.2 และการเติม 1.4 ที่พบมากที่สุดคือการเติม 1,2 ซึ่งไฮโดรเจนจะถูกเติมลงในคาร์บอนซึ่งทำให้เกิดพันธะคู่และที่อุณหภูมิต่ำ ในทางกลับกัน การเติม 1,4 เกิดขึ้นที่อุณหภูมิสูงและเกิดขึ้นเมื่อมีการสะท้อนและลักษณะของวาเลนซ์อิสระในคาร์บอน 1 และ 4 ดูตัวอย่างของแต่ละกรณี:
* ตัวอย่าง 1.2 การเพิ่มในไดอีนคอนจูเกต:
โฮ2C CH ─ CH ═ CH2 + โฮ2 → ฮ2C CH ─ C ─ CH CH2
│ │
H H
* ตัวอย่างการเพิ่ม 1.4 ในไดอีนคอนจูเกต:
โฮ2C CH ─ CH ═ CH2 + โฮ2 → ฮ2C CH ═ CH CH2
│ │
H H
- ไฮโดรจีเนชันของอะโรเมติกส์: พันธะ pi ของวงแหวนเบนซีนจะแตกและอะตอมไฮโดรเจนจะถูกเติมเข้าไปในคาร์บอนที่สร้างพันธะเหล่านี้
ไฮโดรจิเนชันทั้งหมดประเภทนี้แสดงไว้ด้านล่าง:

ปฏิกิริยาไฮโดรจิเนชันของเบนซินทั้งหมด
- ไฮโดรจิเนชันไซแคลน: การก่อตัวของอัลเคนเกิดขึ้น
ตัวอย่าง: การเติมไฮโดรเจนของไซโคลโพรเพน:
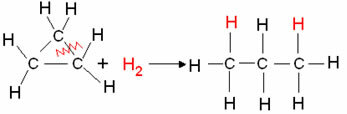
ปฏิกิริยาไฮโดรจิเนชันไซโคลโพรเพน
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm