โอ จุดหลอมเหลวและจุดเดือด คืออุณหภูมิที่วัสดุเปลี่ยนจากของแข็งเป็นของเหลวและจากของเหลวตามลำดับ สำหรับก๊าซหรืออุณหภูมิสูงสุดที่ของเหลวสามารถคงอยู่ในสถานะทางกายภาพนี้ในที่กำหนด ความดัน.
จุดหลอมเหลวและจุดเดือดขององค์ประกอบทางเคมีในตารางธาตุจะแปรผันตามเลขอะตอมของธาตุ ซึ่งหมายความว่าเป็นสมบัติของธาตุ
ในตารางธาตุ ลำดับการเติบโตของอุณหภูมิหลอมเหลวและอุณหภูมิการเดือดขององค์ประกอบทางเคมีเป็นไปตามรูปแบบลูกศรต่อไปนี้
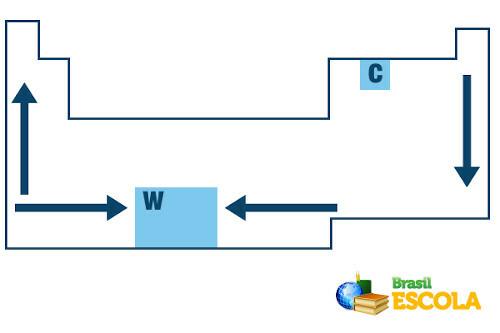
การเติบโตของจุดหลอมเหลวและจุดเดือดในตารางธาตุ
โปรดทราบว่าเมื่อเราพิจารณาองค์ประกอบที่เป็นของตระกูลเดียวกันทางด้านซ้ายของตาราง จุดหลอมเหลวและจุดเดือดลดลงเมื่อเลขอะตอมของธาตุเพิ่มขึ้น กล่าวคือ จากด้านล่างถึง ขึ้น สามารถเห็นได้ในค่าจุดหลอมเหลวและจุดเดือดที่ 1 atm สำหรับองค์ประกอบครอบครัว 1 ที่แสดงด้านล่าง:

จุดหลอมเหลวและจุดเดือดของธาตุตระกูล 1
ทางด้านขวาของตารางธาตุ ตรงกันข้าม ทิศทางการเติบโตของจุดหลอมเหลวและจุดเดือดของธาตุที่เป็นของตระกูลเดียวกันจะเพิ่มขึ้นจากบนลงล่าง ดังนั้นองค์ประกอบที่มีอุณหภูมิหลอมเหลวและจุดเดือดต่ำสุดจึงอยู่ที่ด้านบนของตาราง ข้อยกเว้นเพียงอย่างเดียวคือคาร์บอนซึ่งมีจุดหลอมเหลว 3550 °C และจุดเดือดที่ 4287 °C
มิฉะนั้น ส่วนใหญ่ที่มีจุดหลอมเหลวและจุดเดือดต่ำอาจเป็นก๊าซหรือของเหลวที่อุณหภูมิห้องที่ระดับน้ำทะเล เช่นเดียวกับก๊าซมีตระกูล ไนโตรเจน ออกซิเจน ฟลูออรีน และคลอรีน ซึ่งอยู่ด้านบนขวาของตาราง
ทีนี้ เมื่อพูดถึงองค์ประกอบที่อยู่ในช่วงเวลาเดียวกัน (แถวเดียวกันในตาราง) เราจะเห็นว่าจุดหลอมเหลวและจุดเดือดเพิ่มขึ้นจากด้านข้างมาที่กึ่งกลางของตาราง ดูตัวอย่างองค์ประกอบของช่วงที่สอง:
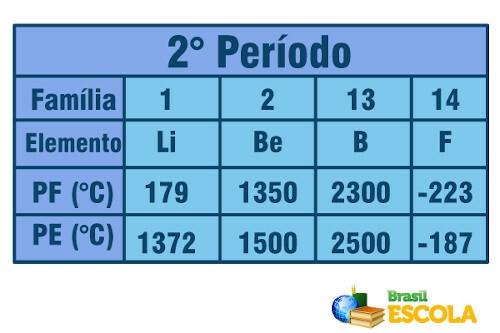
จุดหลอมเหลวและจุดเดือดของธาตุในคาบที่สองของตารางธาตุ
ทังสเตน (W) เป็นธาตุที่อยู่ตรงกลางตารางธาตุและมีจุดหลอมเหลวสูงที่สุดในบรรดาโลหะ โดยมีค่าเท่ากับ3422ºC นั่นเป็นสาเหตุว่าทำไมมันจึงถูกใช้ในหลอดไส้ เนื่องจากสามารถทนต่ออุณหภูมิสูงได้โดยไม่ละลาย
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/ponto-fusao-ebulicaopropriedades-periodicas.htm
