เกิดขึ้นกับ การเปลี่ยนแปลงisochoric เมื่อมวลของก๊าซที่กำหนดผ่านการเปลี่ยนแปลงใน อุณหภูมิ ที่ทำให้ความดันเปลี่ยนแปลงหรือในทางกลับกัน เมื่อพิจารณาจากอุณหภูมินั้นและ ความดันในกรณีนี้เป็นปริมาณตามสัดส่วนโดยตรงในขณะที่ ระดับเสียงของระบบยังคงไม่เปลี่ยนแปลง.
ดูด้วย: ความดันบางส่วนของก๊าซคืออะไร?
การแปลง isochoric คืออะไร?
การแปลงแบบไอโซคอริกคือเมื่อการเปลี่ยนแปลงของอุณหภูมิและความดันเกิดขึ้นกับมวลของก๊าซที่กำหนด แต่ปริมาตรของก๊าซยังคงเท่าเดิม การเปลี่ยนแปลงความดันจะเป็นสัดส่วนโดยตรงกับอุณหภูมิกล่าวคือ ถ้าก๊าซในระบบปิดบางระบบ เพิ่มอุณหภูมิสัมบูรณ์เป็นสองเท่า จะทำให้ความดันเพิ่มขึ้นเป็นสองเท่าจากเดิม
การเปลี่ยนแปลงประเภทนี้เรียกอีกอย่างว่า isovolumetric หรือ isometric. ศัพท์ isochoric มาจากภาษากรีก อิโซโครา, เกี่ยวกับอะไร iso หมายถึง "เท่าเทียมกัน" และ โคราช หมายถึง “สถานที่หรือปริมาตร” (ในบริบทนี้)
ตัวอย่าง:
ยางรถยนต์มีการเปลี่ยนแปลงแบบไอโซโคริก เราสามารถสังเกตสิ่งนี้ได้เมื่อเราสร้างมัน การสอบเทียบ ในวันที่อากาศร้อน ความดันที่กำหนดบนจอภาพสอบเทียบจะสูงกว่าในวันที่อากาศเย็น นี่เป็นเพราะอุณหภูมิที่เพิ่มขึ้นความดันจะเพิ่มขึ้นเนื่องจากปริมาตรยังคงอยู่

ตัวอย่างอื่นๆ ได้แก่ สเปรย์ระงับกลิ่นกาย,ในผลิตภัณฑ์ประเภทนี้มีคำเตือนบนฉลากว่าไม่ให้เก็บหรืออยู่ภายใต้อุณหภูมิสูง, เพราะนอกจากสารบางชนิดที่ติดไฟได้ ยังมีสภาวะของการเปลี่ยนแปลงไอโซโคริกหรือ ไอโซโวลูเมตริก เนื่องจากสเปรย์ดับกลิ่นอยู่ในขวดที่ปิดสนิทและอยู่ในสถานะก๊าซ อุณหภูมิที่เพิ่มขึ้นจะนำไปสู่การเพิ่มขึ้นของความดันและความเสี่ยงของการระเบิด.
ลักษณะของการแปลงไอโซคอริก
- ปริมาณคงที่
- ความดันและอุณหภูมิเป็นสัดส่วนโดยตรง
ลักษณะเหล่านี้สามารถอธิบายได้ด้วยสูตรต่อไปนี้:

กราฟของฟังก์ชันไอโซโคริก
สังเกตตารางต่อไปนี้ซึ่งอธิบายพฤติกรรมของก๊าซที่สัมพันธ์กับความดัน อุณหภูมิ และค่าคงที่ผลลัพธ์
อุณหภูมิ (°C) |
ความดัน (atm) |
P/T = ค่าคงที่ |
50 |
5 |
10 |
100 |
10 |
10 |
150 |
15 |
10 |
200 |
20 |
10 |
โปรดทราบว่าความดันตามอุณหภูมิที่เพิ่มขึ้นเพื่อให้อัตราส่วน P/T คงที่ หมายความว่าความดันและอุณหภูมิเป็นปริมาณตามสัดส่วนโดยตรง ดังนั้น กราฟที่อธิบายการแปลงแบบไอโซคอริกจึงเป็นแบบเชิงเส้น ดู:

ใครเป็นผู้ค้นพบการเปลี่ยนแปลงไอโซคอริก?
Jacques Alexandre César Charles (1746-1823) เป็นนักวิทยาศาสตร์ชาวฝรั่งเศสที่ศึกษาพฤติกรรมของก๊าซในระบบปิดเพื่อสร้างเทอร์โมมิเตอร์ที่มีความแม่นยำ สรุปการศึกษาเกี่ยวกับการเปลี่ยนแปลงไอโซโคริก
นักวิทยาศาสตร์ โจเซฟ หลุยส์ เกย์-ลุสซัก (พ.ศ. 2321-2593) ยังได้พัฒนาการศึกษาการขยายตัวและการหดตัวของระบบก๊าซ นี่เป็นการวิเคราะห์ที่เป็นอิสระ แต่เนื่องจากพวกเขาได้ข้อสรุปเดียวกัน พวกเขาจึงแบ่งหน่วยกิต วันนี้ผู้เขียนบางคนอ้างถึงกฎทางกายภาพสองข้อสุดท้ายของก๊าซที่อธิบาย การแปลงไอโซบาริก และ isochoric like กฎข้อที่ 1 และ 2 ของ Charles-Gay-Lussac.
ดูด้วย: กฎปริมาตรของเกย์-ลูสแซก
การออกกำลังกายได้รับการแก้ไขแล้ว
คำถามที่ 1 - (PUC-RJ) ยางรถจักรยานถูกปรับเทียบที่ความดัน 4 atm ในวันที่อากาศหนาว ที่อุณหภูมิ 7 °C ปริมาณและปริมาณของก๊าซที่ฉีดจะเท่ากัน แรงดันสอบเทียบในยางจะเป็นอย่างไรเมื่ออุณหภูมิถึง 37°C?
ก) 21.1 ตู้เอทีเอ็ม
b) 4.4 atm
ค) 0.9 atm
ง) 760 mmHg
จ) 2.2 atm
ความละเอียด
ทางเลือก A
ขั้นตอนที่ 1 ระบุระบบและดึงข้อมูล
ระบบไอโซโวลูเมตริก
P1 = 4 atm
T1 = 7°C
T2 = 37°C
P2 = ?
ใช้สูตร:
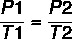
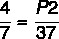
7 x P2 = 37 x 4
P2 = 148 / 7
P2 = 21.14 atm
คำถามที่ 2 - (Unifor-CE) ตรวจสอบรูปด้านล่าง
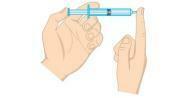
แรงดันแก๊สภายในกระบอกฉีดยาสามารถลดลงได้:
ก) วางกระบอกฉีดยาลงในน้ำเย็นจัดโดยปิดฝาท้ายไว้
b) บีบลูกสูบโดยปิดปลายไว้
c) วางกระบอกฉีดยาลงในน้ำร้อนโดยปิดฝาท้ายไว้
d) เปิดปลายและไล่ลมครึ่งหนึ่งออกจากกระบอกฉีดยา
จ) ดึงลูกสูบโดยเปิดปลายไว้
ความละเอียด
ทางเลือก ก. ความดันของแก๊สเป็นสัดส่วนโดยตรงกับอุณหภูมิในระบบไอโซโคริก กล่าวคือ โดยไม่เปลี่ยนปริมาตรหรือมวลของแก๊ส เมื่ออุณหภูมิลดลง แรงดันจะลดลงด้วย
โดย Laysa Bernardes Marques de Araujo
ครูสอนเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/transformacao-isocorica.htm

