THE ไฮโดรไลซิสของเกลือ ระหว่างกรดแก่และเบสแก่ มันเกิดขึ้นเมื่อไอออนบวกในเกลือไม่มีปฏิกิริยากับไอออนบวกในน้ำ และประจุลบในเกลือไม่มีปฏิกิริยากับไอออนบวกในน้ำ ไฮโดรไลซิสระหว่างไอออนบวกและแอนไอออนของเกลือและน้ำจะเกิดขึ้นก็ต่อเมื่อผลิตภัณฑ์ที่เกิดขึ้นเป็นกรดอ่อน เบสอ่อน หรือทั้งสองอย่าง ทำความเข้าใจการไฮโดรไลซิสของเกลือระหว่างกรดแก่และเบสแก่ทีละขั้นตอน:
ก) ขั้นตอนที่ 1: น้ำแตกตัวเป็นไอออน
น้ำเป็นสารที่มีความสามารถในการทนทุกข์ การทำให้เป็นอัตโนมัติกล่าวคือผลิตไฮโดรเนียมไอออนบวก (H+) และไฮดรอกไซด์แอนไอออน (OH-) จากโครงสร้าง
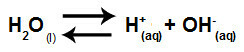
สมการแทนไอออนไนซ์ในตัวเองของน้ำ
ข) ขั้นตอนที่ 2: ความแตกแยก เกลือ
เมื่อเติมเกลือลงในน้ำ เกลือจะผ่านกระบวนการแยกตัวออกจากกัน เนื่องจากเกลือเป็นสารประกอบไอออนิก ในน้ำ ไพเพอร์และแอนไอออนของเกลือจะถูกปล่อยออกสู่ตัวกลาง ดังในสมการที่แสดงด้านล่าง:
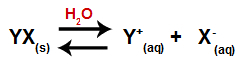
สมการแทนการแตกตัวของเกลือใดๆ
c) ขั้นตอนที่ 3: การไฮโดรไลซิสของเกลือของกรดและเบสแก่
สำหรับกรดแก่: เมื่อประจุลบของเกลือรวมกับH+ ของน้ำให้กลายเป็น HCl, HBr, HI หรือกรดอื่น ๆ ซึ่งการลบจำนวนออกซิเจนด้วยจำนวนไฮโดรเจนเท่ากับหรือมากกว่า 2 เราจะมี กรดแก่. ดังนั้นจึงไม่เกิดการรวมตัวระหว่างไอออนที่กล่าวถึง
สำหรับรากฐานที่แข็งแกร่ง: เมื่อไอออนบวกของเกลือที่เป็นของ IA (โลหะอัลคาไล) หรือ IIA (โลหะอัลคาไลน์เอิร์ทอื่นที่ไม่ใช่แมกนีเซียม) รวมกับ OH- ของน้ำ ก็จะเกิดเป็น รากฐานที่แข็งแกร่ง. ดังนั้นจึงไม่เกิดการรวมตัวระหว่างไอออนที่กล่าวถึง
เมื่อเกลือไอออนไม่มีปฏิกิริยากับไอออนของน้ำ เรามีสมการดังต่อไปนี้:
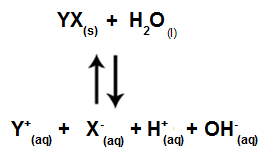
สมการที่แสดงไอออนทั้งหมดที่มีอยู่ในสารละลาย
โดยสรุป เนื่องจากไอออนของเกลือไม่มีปฏิกิริยากับไอออนของน้ำ ไอออนของเกลือจึงไม่ส่งเสริมการเปลี่ยนแปลงใดๆ ในสารละลายสุดท้าย ดังนั้น เราสามารถเขียนสมการของการไฮโดรไลซิสของเกลือระหว่างกรดแก่กับเบสแก่ได้ด้วยสมการไอออไนซ์ของน้ำ
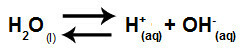
สมการแทนการไฮโดรไลซิสของกรดและเบสแก่
d) ตัวอย่างของการไฮโดรไลซิสของเกลือระหว่างกรดแก่และด่างอย่างแรง
เมื่อเราเติมเกลือโพแทสเซียมคลอเรตลงในน้ำ (KClO3) เกลือจะแยกตัวและปล่อยโพแทสเซียมไอออน (K+) และคลอรีนแอนไอออน (ClO3-) อยู่กึ่งกลาง.
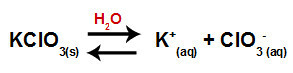
สมการการแยกตัวของโพแทสเซียมคลอเรต
สิ่งสำคัญคือต้องจำไว้ว่าน้ำผ่านการแตกตัวเป็นไอออนในตัวเองและให้ไฮโดรเจนไอออนกับตัวกลาง (H+) และไฮดรอกไซด์แอนไอออน (OH-). ตอนนี้เราต้องประเมินปฏิสัมพันธ์ระหว่างเกลือกับไอออนของน้ำ
เมื่อ H+ โต้ตอบกับ ClO3-ทำให้เกิดกรดเปอร์คลอริก (HclO3). เนื่องจากการลบจำนวนออกซิเจนด้วยจำนวนไฮโดรเจนที่แตกตัวเป็นไอออนได้ในกรดเปอร์คลอริกคือ 2 จึงมีความแข็งแรง ดังนั้นปฏิสัมพันธ์ระหว่างไอออนจึงไม่เกิดขึ้น
เมื่อ K cation+ โต้ตอบกับ OH anion-เรามีการก่อตัวเป็นเบสที่แข็งแรง เนื่องจากโพแทสเซียมเป็นโลหะอัลคาไล ดังนั้นปฏิสัมพันธ์ระหว่างไอออนจึงไม่เกิดขึ้น
สมการที่แสดงการไฮโดรไลซิสของเกลือระหว่างกรดแก่และเบสแก่จากการละลายของโพแทสเซียมคลอเรตในน้ำคือ
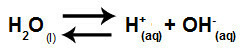
สมการทางเคมีของโพแทสเซียมคลอเรตไฮโดรไลซิส
By Me. Diogo Lopes Dias
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm
