นักเคมีชาวฝรั่งเศส Henry Louis Le Chatelier กล่าวว่า กะสมดุล เป็นสถานการณ์ที่ปฏิกิริยาเคมีเปลี่ยนไป (ไปข้างหน้าหรือย้อนกลับ) เมื่ออยู่ภายใต้การรบกวนจากภายนอก คำสั่งนี้เสนอโดยนักเคมีกลายเป็นที่รู้จักในนาม หลักการของ Le Chatelier.
บันทึก: ปฏิกิริยาโดยตรงคือปฏิกิริยาที่สารตั้งต้นถูกเปลี่ยนเป็นผลิตภัณฑ์ในขณะที่ปฏิกิริยาผกผันคือปฏิกิริยาที่ผลิตภัณฑ์ถูกเปลี่ยนเป็นสารตั้งต้น
ปฏิกิริยาจะอยู่ในภาวะสมดุลเมื่อความเร็วของปฏิกิริยาโดยตรงเท่ากับปฏิกิริยาย้อนกลับ กล่าวคือ สารตั้งต้นเปลี่ยนเป็นผลิตภัณฑ์ในอัตราเดียวกับผลิตภัณฑ์เปลี่ยนเป็นสารตั้งต้น

การแสดงทั่วไปของปฏิกิริยาเคมีสมดุล
ตามหลักการของเลอ ชาเตอลิเยร์ เมื่อใดก็ตามที่แรงกระทำกับปฏิกิริยาสมดุล กะสมดุล มันจะเกิดขึ้นเพื่อลบล้างการรบกวนนี้และสร้างสถานการณ์สมดุลใหม่ในปฏิกิริยา
รบกวนที่สามารถ ปรับสมดุลเคมี พวกเขาเป็น:
→ ความผันแปรของความเข้มข้น
เมื่อ ความเข้มข้นของสสาร (เป็นโมล/ลิตรหรือโมลาร์) ของผู้เข้าร่วมในปฏิกิริยาเปลี่ยนไป (ลดลงหรือเพิ่มขึ้น) กะสมดุลตราบใดที่ผู้เข้าร่วมนั้นไม่อยู่ในสถานะที่มั่นคง
ดังนั้น ตามหลักการของเลอ ชาเตอลิเยร์ ถ้า ความเข้มข้น หากผู้เข้าร่วมเพิ่มขึ้น ความสมดุลจะเปลี่ยนไปในทิศทางตรงกันข้ามกับการเพิ่มขึ้น อย่างไรก็ตาม หาก
ความเข้มข้น ผู้เข้าร่วมจะลดลงจะมีการกระจัดของความสมดุลในทิศทางของการลดลง ตัวอย่างเช่น:
การแสดงทั่วไปของปฏิกิริยาเคมีสมดุล
เพิ่มความเข้มข้นของ A = สมดุลเลื่อนไปทางขวา
ลดความเข้มข้นของ B = สมดุลเลื่อนไปทางซ้าย
→ รูปแบบของ ความดัน
ความแปรผันของความดันเพียงส่งเสริม การเปลี่ยนแปลงในสมดุล ที่มีส่วนประกอบของก๊าซ เนื่องจากเมื่อเพิ่มขึ้นโมเลกุลจะเพิ่มการชนกัน และเมื่อความดันลดลง จะลดการชนกันของกันและกัน
การชนกันระหว่างโมเลกุลเพิ่มขึ้นตามการเพิ่มขึ้น ความดัน, เพราะปริมาตร (ช่องว่าง) จะลดลงตามไปด้วย ในขณะที่ลด ความดัน มาพร้อมกับปริมาณที่เพิ่มขึ้น
บันทึก: ในสมดุลเคมี การวิเคราะห์ผลของการปรับเปลี่ยนแรงดันจะพิจารณาถึงปริมาตรโมลาร์ของสารตั้งต้นและผลิตภัณฑ์ ซึ่งปริมาตรนั้นสัมพันธ์กับค่าสัมประสิทธิ์ปฏิกิริยา ในสมการด้านล่าง ปริมาตรรีเอเจนต์คือ 4 และผลิตภัณฑ์คือ 2
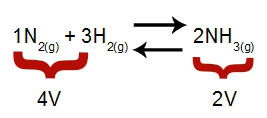
สมการที่ระบุปริมาตรที่มีอยู่ในการก่อตัวของแอมโมเนีย
ตามหลักการของเลอ ชาเตอลิเยร์ ถ้าความดันของระบบเพิ่มขึ้น การกระจัดของ สมดุลในทิศทางของปริมาตรที่มากขึ้น ในขณะที่ถ้าความดันลดลง การกระจัดของ สมดุล.

สมการที่แสดงถึงความสมดุลของการก่อตัวของแอมโมเนีย
แรงดันที่เพิ่มขึ้น = ความสมดุลเลื่อนไปทางขวา (เพราะเป็นด้านที่มีปริมาตรน้อยที่สุด)
แรงดันที่ลดลง = ความสมดุลจะเลื่อนไปทางซ้าย (เพราะเป็นด้านปริมาณที่สูงกว่า)
→ ความแปรปรวนของอุณหภูมิ
เพิ่มขึ้นใน อุณหภูมิ ของปฏิกิริยาในสภาวะสมดุลช่วยให้โมเลกุลเกิดการปะทะกันมากขึ้น ในขณะที่การลดลงของ อุณหภูมิลดความกระวนกระวายใจและส่งผลให้แรงกระแทกลดลง เนื่องจากอุณหภูมิที่เพิ่มขึ้นมักทำให้เกิดปฏิกิริยา ดูดความร้อน (หนึ่งที่ดูดซับพลังงาน).
การวิเคราะห์ผลกระทบของอุณหภูมิต่อความสมดุลนั้นคำนึงถึง ΔH ของปฏิกิริยาเป็นหลัก ถ้า ΔH เป็นบวก ปฏิกิริยาไปข้างหน้าจะเป็นดูดความร้อน ในขณะที่ปฏิกิริยาย้อนกลับจะเป็นปฏิกิริยาคายความร้อน ถ้า ΔH เป็นลบ ตัวขวาจะเป็นคายความร้อนและตัวผกผันคือดูดความร้อน
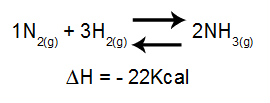
สมการที่มีการเปลี่ยนแปลงเอนทาลปีในการก่อตัวของแอมโมเนีย
อุณหภูมิที่เพิ่มขึ้น = สมดุลเลื่อนไปทางซ้าย (เพราะนี่คือทิศทางของปฏิกิริยาดูดความร้อน เนื่องจาก ΔH เป็นลบ)
อุณหภูมิที่ลดลง = สมดุลเลื่อนไปทางขวา (เพราะนี่คือทิศทางของปฏิกิริยาคายความร้อน เนื่องจาก ΔH เป็นลบ)
By Me. Diogo Lopes Dias
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-deslocamento-equilibrio.htm


