ใน ปฏิกิริยาการเติมใน แอลคีน(ไฮโดรคาร์บอนที่มีพันธะคู่ระหว่างอะตอมของคาร์บอนสองอะตอม) พันธะ pi ระหว่างสองคาร์บอนจะแตกสลาย และคาร์บอนแต่ละตัวจะเกาะติดกับอะตอมใหม่ ดู:
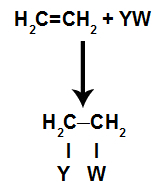
แบบจำลองแผนผังทั่วไปของปฏิกิริยาการเติม
หลักการของปฏิกิริยาการเติม
a) การแตกของ pi link
พันธะ pi แตกง่ายเพราะเป็นพันธะที่อ่อนแอกว่าพันธะซิกมา อย่างไรก็ตาม เพื่อให้สิ่งนี้เกิดขึ้น จำเป็นที่อัลคีนต้องอยู่ภายใต้เงื่อนไขที่ทำให้เกิดการหยุดชะงักนี้ หลังจากทำลายพันธะ pi ระหว่างคาร์บอนสองชนิดแล้ว ตำแหน่งพันธะ (สำหรับอะตอมใหม่) จะปรากฏขึ้นบนคาร์บอนที่เกี่ยวข้องแต่ละตัวเสมอ
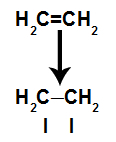
แผนผังแสดงการแตกลิงก์ pi
b) เงื่อนไขในการทำลายพันธะ pi
ปัจจัยที่สนับสนุนการแตกหักของพันธะ pi คือ:
การใช้ตัวเร่งปฏิกิริยา
เครื่องทำความร้อน;
การปรากฏตัวของกรดในตัวกลางปฏิกิริยา
c) การเกิดขึ้นของปฏิกิริยาการเติม
ตำแหน่งการยึดเกาะที่สร้างขึ้นหลังจาก pi-bond ถูกทำลายจะถูกครอบครองโดยอะตอมของสารตั้งต้นที่อยู่ในภาชนะเดียวกันกับอัลคีนเสมอ ปฏิกิริยาการเติมถูกตั้งชื่อตามชนิดของรีเอเจนต์ที่ผสมกับอัลคีน
ประเภทของปฏิกิริยาเพิ่มเติมใน Alkenes
ก) ไฮโดรจีเนชัน
แอลคีนผสมกับก๊าซไฮโดรเจน (H2) ในภาชนะและอยู่ภายใต้การกระทำของตัวเร่งปฏิกิริยาที่เป็นของแข็ง (นิกเกิล แพลตตินั่ม หรือแพลเลเดียม) และความร้อน (Δ)
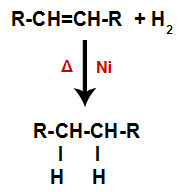
รูปแบบทั่วไปของปฏิกิริยาไฮโดรจิเนชันในแอลคีน
การปรากฏตัวของตัวเร่งปฏิกิริยาและความร้อนทำให้เกิดพันธะ pi ของอัลคีนและพันธะซิกมาระหว่างไฮโดรเจนของ H2 จะแตกเร็วขึ้น ด้วยเหตุนี้ เราจึงมีการสร้างตำแหน่งพันธะสองแห่งในอัลคีนและอะตอมไฮโดรเจนอิสระสองอะตอมในตัวกลางของปฏิกิริยา

การสร้างพันธะอะตอมและไซต์แยก
ดังนั้นในทันทีหลังจากนั้น อะตอมของไฮโดรเจนอิสระแต่ละอะตอมจะยึดบริเวณพันธะที่เกิดขึ้นในอัลคีน เนื่องจากสารที่ก่อตัวขึ้นมีเพียงคาร์บอนและไฮโดรเจนเท่านั้น เช่นเดียวกับพันธะธรรมดาระหว่างคาร์บอนเท่านั้น จึงเป็น ด่าง.
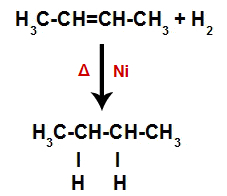
สมการที่แสดงถึงการก่อตัวของอัลเคนในไฮโดรจิเนชัน
ข) ฮาโลเจน
แอลคีนผสมกับสารธรรมดา (F2, Cl2, br2 เฮ้2) ก่อตั้งโดย ฮาโลเจน (คลอรีน ฟลูออรีน ไอโอดีน และโบรมีน) ในภาชนะและอยู่ภายใต้การกระทำของแสง (λ) และความร้อน (Δ)

รูปแบบทั่วไปของปฏิกิริยาฮาโลเจนในแอลคีน
การกระทำของแสงและความร้อนทำให้พันธะ pi ของอัลคีนและพันธะซิกมาระหว่างสารที่เกิดจากฮาโลเจนแตกตัวเร็วขึ้น ด้วยเหตุนี้ เราจึงมีการสร้างตำแหน่งการจับสองแห่งในอัลคีนและอะตอมของฮาโลเจนอิสระสองอะตอมในตัวกลางของปฏิกิริยา

การสร้างพันธะอะตอมและไซต์แยก
ดังนั้น ในทันทีหลังจากนั้น อะตอมของฮาโลเจนอิสระแต่ละอะตอมจะครอบครองตำแหน่งพันธะที่เกิดขึ้นในแอลคีน เนื่องจากสารที่ก่อตัวขึ้นมีฮาโลเจนที่เชื่อมโยงกับโครงสร้างที่ประกอบด้วยคาร์บอนและไฮโดรเจน จึงเป็น อินทรีย์เฮไลด์.

สมการที่แทนการก่อรูปอินทรีย์เฮไลด์ในฮาโลจิเนชัน
ค) ไฮเดรชั่น
แอลคีนผสมกับน้ำ (H2O) ในภาชนะและอยู่ภายใต้การกระทำของตัวเร่งปฏิกิริยา (ในกรณีนี้คือกรดซัลฟิวริก)
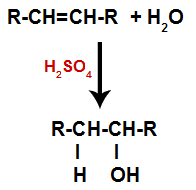
รูปแบบทั่วไปของปฏิกิริยาไฮเดรชั่นในแอลคีน
การปรากฏตัวของกรดซัลฟิวริกในปฏิกิริยาทำให้พันธะ pi ของอัลคีนและพันธะซิกมาระหว่างไฮโดรเจน (H) กับไฮดรอกซิล (OH) ของน้ำจะแตกตัวเร็วขึ้น ด้วยเหตุนี้ เราจึงมีการสร้างตำแหน่งพันธะสองแห่งในแอลคีนและไฮโดรเจนอิสระหนึ่งตัวและไฮดรอกซิลหนึ่งแห่งในตัวกลางของปฏิกิริยา
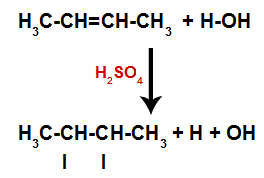
การสร้างพันธะอะตอมและไซต์แยก
ดังนั้นหลังจากนั้นไม่นาน ไฮโดรเจนและไฮดรอกซิลก็เข้ายึดบริเวณพันธะที่เกิดขึ้นในอัลคีน เนื่องจากสารที่ก่อตัวขึ้นมีไฮดรอกซิลจับกับคาร์บอนอิ่มตัว (ทำให้เกิดพันธะอย่างง่ายเท่านั้น) จึงเป็นแอลกอฮอล์
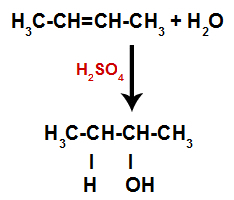
สมการแทนการก่อตัวของแอลกอฮอล์ในการให้น้ำ
d) การเติมไฮโดรเจนเฮไลด์
แอลคีนผสมกับกรดอนินทรีย์ฮาโลจิเนต (HF, HI, HCl, HBr) ในภาชนะ

รูปแบบทั่วไปของปฏิกิริยากรดเฮไลด์ในแอลคีน
การปรากฏตัวของกรดในปฏิกิริยาทำให้พันธะ pi ของอัลคีนแตกเร็วขึ้น พันธะเดี่ยวในกรดจะแตกเพราะสารเหล่านี้แตกตัวเป็นไอออนตามธรรมชาติ ดังนั้น ตำแหน่งการจับสองแห่งจึงถูกสร้างขึ้นในอัลคีน และมีไฮโดรเจนอิสระและฮาโลเจนในตัวกลางของปฏิกิริยา
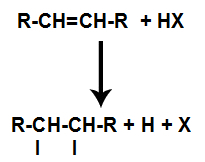
การสร้างพันธะอะตอมและไซต์แยก
ดังนั้น ไม่นานหลังจากนั้น ไฮโดรเจนและฮาโลเจนจะครอบครองหนึ่งในตำแหน่งพันธะที่เกิดขึ้นในอัลคีน เนื่องจากสารที่ก่อตัวขึ้นมีฮาโลเจนที่เชื่อมโยงกับโครงสร้างที่ประกอบด้วยคาร์บอนและไฮโดรเจน สารนี้จึงเป็นเฮไลด์อินทรีย์
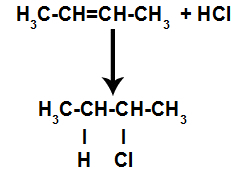
สมการที่แทนการก่อรูปอินทรีย์เฮไลด์ในฮาโลจิเนชัน
By Me. Diogo Lopes Dias
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/reacoes-adicao-alcenos.htm

