Vladimir Vasilyevich Markovnikov (1838-1904) เป็นนักเคมีชาวมอสโกซึ่งในปี 1869 เริ่มศึกษาปฏิกิริยาบางอย่างของการเพิ่มไฮโดรเจนเฮไลด์ลงในแอลคีนและอัลไคเนส
ในปฏิกิริยาเหล่านี้ แอลคีนทำปฏิกิริยากับไฮโดรเจนเฮไลด์หรือกรดไฮโดรฮาลิก เช่น ไฮโดรเจนคลอไรด์ (HCl), ไฮโดรเจนโบรไมด์ (HBr) และไฮโดรเจนไอโอไดด์ (HI) ผลิตภัณฑ์ที่เกิดขึ้นจากอัลคีนคืออัลคิลเฮไลด์ เนื่องจากไฮโดรเจนจับกับคาร์บอนตัวใดตัวหนึ่งของคู่และพันธะฮาโลเจนกับอีกตัวหนึ่ง ดูตัวอย่างด้านล่าง:
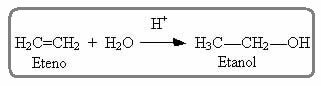
สิ่งที่คล้ายกันก็เกิดขึ้นในปฏิกิริยาไฮเดรชั่นของแอลคีนในตัวกลางที่เป็นกรด ซึ่งผลิตภัณฑ์ที่เกิดขึ้นเป็นแอลกอฮอล์:
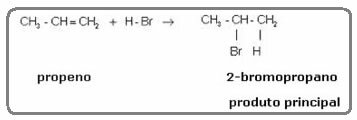
โมเลกุลเอทิลีนที่กล่าวถึงข้างต้นมีความสมมาตร ดังนั้นจึงไม่สำคัญว่าคาร์บอนใดที่ไฮโดรเจนและฮาโลเจนจะถูกเติมเข้าไปตามลำดับ อย่างไรก็ตาม ในโมเลกุลที่ไม่สมมาตร เช่น โพรพีน เราคาดหวังว่าจะเกิดผลิตภัณฑ์สองชนิดที่เป็นไปได้ อย่างไรก็ตาม Markovnikov เห็นว่าสิ่งนี้ไม่ได้เกิดขึ้นในทางปฏิบัติ เพื่อให้เข้าใจ ให้ดูปฏิกิริยาด้านล่าง:
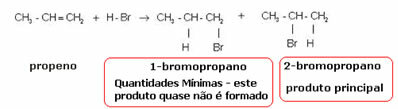
ผลิตภัณฑ์ที่เกิดขึ้นจริงเพียงอย่างเดียวคือ 2-bromopropane และ Markovnikov เห็นว่าสิ่งนี้เป็นจริงสำหรับสารอื่นเช่นกัน ท่านจึงตั้งกฎไว้ดังนี้

เช่นเดียวกับการเพิ่มน้ำ เนื่องจากทั้งโมเลกุลของน้ำและไฮโดรเจนเฮไลด์มีขั้ว ดังนั้น ไฮโดรเจนของโมเลกุลเหล่านี้จึงมีลักษณะทางไฟฟ้าบวก
โฮδ+_ X δ- และ Hδ+_ โอ้ δ-
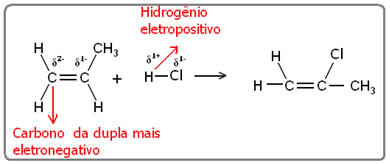
ไฮโดรเจนจะจับกับคาร์บอนที่มีอิเล็กโตรเนกาทีฟมากที่สุด ซึ่งจะจับกับไฮโดรเจนในปริมาณที่มากที่สุด ดังนั้นเราจึงมี:
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ทีมโรงเรียนบราซิล
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/regra-markovnikov.htm
