สารประกอบบางชนิดไม่จำเป็นต้องมีอิเล็กตรอนแปดตัวในเปลือกเวเลนซ์เพื่อให้เกิดความเสถียร ดังนั้นจึงถือว่าเป็นข้อยกเว้นสำหรับกฎออคเต็ต เรียนรู้ตอนนี้ว่าทำไมองค์ประกอบบางอย่างจึงหลีกเลี่ยงภาระหน้าที่ของการมีอิเล็กตรอนในเปลือกสุดท้าย
เบริลเลียม (เป็น)
เป็นข้อยกเว้นของกฎออคเต็ต เนื่องจากสามารถสร้างสารประกอบที่มีพันธะเดี่ยวสองพันธะ ดังนั้นจึงทำให้เสถียรด้วยอิเล็กตรอนเพียงสี่ตัวในเปลือกเวเลนซ์ 
เนื่องจากไฮโดรเจน (H) จำเป็นต้องให้อิเล็กตรอนสองตัวเพื่อสร้างพันธะ (H - ดี - H) อะตอมของเบริลเลียม (Be) ใช้อิเล็กตรอนร่วมกันและมีความเสถียร
อลูมิเนียม (อัล)
เป็นข้อยกเว้นของกฎออคเต็ต เพราะมันทำให้เสถียรด้วยอิเล็กตรอนหกตัวในเปลือกเวเลนซ์ อะตอมอะลูมิเนียมมีแนวโน้มที่จะบริจาคอิเล็กตรอน ดังนั้นจึงสามารถสร้างพันธะเดี่ยวสามพันธะกับอะตอมอื่นๆ: 
ในกรณีนี้ อะลูมิเนียม (Al) เกิดพันธะสามพันธะกับฟลูออรีน (F) สามอะตอม
โบรอน (ข)
มันสร้างสารโมเลกุลที่มีพันธะเดี่ยวสามพันธะ 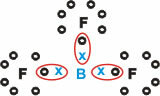
โปรดทราบว่าโบรอน (B) มีแนวโน้มที่จะบริจาคอิเล็กตรอนให้กับอะตอมของฟลูออรีน (F) ซึ่งเป็นไปตามกฎออคเต็ต ซึ่งต้องใช้อิเล็กตรอนแปดตัวในเปลือกเวเลนซ์ เมื่อโบรอนปล่อยอิเลคตรอน ฟลูออรีนจะคงตัวด้วยออคเต็ตที่ก่อตัวขึ้น
โดย Liria Alves
จบเคมี
ทีมโรงเรียนบราซิล
ดูเพิ่มเติม!
ทฤษฎีออคเต็ต
เคมีทั่วไป - เคมี - โรงเรียนบราซิล
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm

