พลังงานออกซิเดชันใน แอลคีน เป็นปฏิกิริยาอินทรีย์ที่เกิดขึ้นเมื่ออัลไคน์ (ไฮโดรคาร์บอนที่มีพันธะสามระหว่างสองคาร์บอน) ถูกเติมลงในสารละลายที่เป็นกรดด้วย น้ำยาของ ไบเออร์ (โพแทสเซียมเปอร์แมงกาเนต - KMnO4).
หมายเหตุ: ปฏิกิริยาของ ออกซิเดชันของพลังงาน สามารถทำได้ด้วยโพแทสเซียมไดโครเมต (K2Cr2อู๋7) และไม่ใช่แค่โพแทสเซียมเปอร์แมงกาเนตเท่านั้น
เมื่อใดก็ตามที่มีปฏิกิริยาจาก ออกซิเดชันอย่างมีพลังในอัลไคน์ ผลิตภัณฑ์ที่สามารถกำเนิดได้คือ กรดคาร์บอกซิลิก, น้ำ (รายการเดียวที่ปรากฏในรายการใดรายการหนึ่ง) และคาร์บอนไดออกไซด์ (CO2).
รีเอเจนต์ของไบเออร์ในตัวกลางที่เป็นกรด
เมื่อรีเอเจนต์ของไบเออร์ผสมกับน้ำต่อหน้า a กรด (สารที่สามารถปล่อย H ไอออน+) การก่อตัวของสอง ออกไซด์ (โพแทสเซียมออกไซด์และแมงกานีสออกไซด์ II) และออกซิเจนตั้งไข่ ([O])

กลไกการเกิดออกซิเดชันของพลังงานในแอลไคน์
กลไกที่ 1: ทำลายพันธะสาม
ในขั้นต้น พันธะสามตัวถูกโจมตีโดยออกซิเจนที่เกิดใหม่ซึ่งเกิดจากรีเอเจนต์ของเบเยอร์ การโจมตีครั้งนี้ทำให้สายสัมพันธ์ทั้งสามถูกทำลายอย่างสมบูรณ์
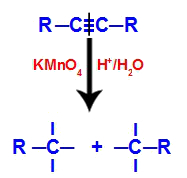
การหยุดชะงักของพันธะสามโดยการโจมตีของออกซิเจนตั้งไข่
เมื่อพันธะสามแตก แอลไคน์จะถูกแบ่งออกเป็นสองส่วน คาร์บอนแต่ละอันที่มีพันธะสามชั้น วาเลนซ์อิสระสามตัวปรากฏขึ้น
กลไกที่ 2: ปฏิกิริยาของกลุ่มไฮดรอกซิล
เวเลนซ์อิสระแต่ละตัวบนคาร์บอนโดยที่พันธะสามถูกครอบครองโดยหมู่ไฮดรอกซิล (OH) ก่อตัวเป็นโพลิออล (แอลกอฮอล์ ด้วยไฮดรอกซิลหลายชนิด)
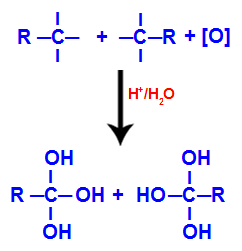
การก่อรูปของพอลิออลกับหมู่ไฮดรอกซิลหลังการตัดแยกพันธะสามตัว
บันทึก: หากคาร์บอนที่พันธะสามเคยมีมีอะตอมไฮโดรเจนติดอยู่ อะตอมของไฮโดรเจนนั้นจะได้รับออกซิเจนตั้งไข่และก่อตัวเป็นไฮดรอกซิลอีกตัวหนึ่งด้วย
กลไกที่ 3: การก่อตัวของโมเลกุลของน้ำ
เมื่อคาร์บอนมีหมู่ OH สองกลุ่มขึ้นไป มันจะกลายเป็นโครงสร้างที่ไม่เสถียรมากเนื่องจากการมีอยู่ของอย่างมาก อิเล็กโทรเนกาทีฟ. ดังนั้น เนื่องจากความไม่เสถียร โมเลกุลจึงเกิดการคายน้ำในตัวเอง กล่าวคือ ไฮดรอกซิลจับกับไฮโดรเนียม (H+) จากไฮดรอกซิลอื่นและก่อตัวเป็นน้ำ

การก่อตัวของโมเลกุลของน้ำจากไฮดรอกซิลสองตัวที่มีอยู่ในโพลิออลที่เกิดขึ้น
กลไกที่ 4: การสร้างผลิตภัณฑ์
หลังจากการก่อตัวของโมเลกุลของน้ำ คาร์บอนจะสูญเสียพันธะเนื่องจากทางออกของ a ไฮดรอกซิลและออกซิเจนของไฮดรอกซิลอื่นก็สูญเสียพันธะที่สร้างด้วยa ไฮโดรเจน ดังนั้นระหว่างคาร์บอนและออกซิเจนนี้ พันธะคู่จึงปรากฏขึ้น ซึ่งก่อตัวเป็นคาร์บอนิล (C=O) และทำให้ทั้งสองมีความเสถียร
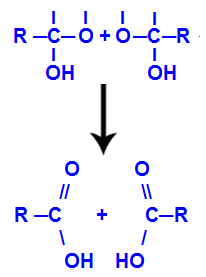
การเกิดคาร์บอนิลในโครงสร้างทั้งสองที่ได้จากอัลไคน์
ตัวอย่างสมการออกซิเดชันพลังงานแอลไคน์
ตัวอย่าง: ออกซิเดชันที่มีพลังของ But-1-ino
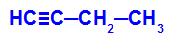
สูตรโครงสร้างของ but-1-yne
เมื่อใส่ but-1-yne ลงในสื่อที่มีรีเอเจนต์ น้ำ และกรดของไบเออร์ พันธะจะแตก มีอยู่สามเท่าระหว่างคาร์บอน 1 และ 2 เนื่องจากการโจมตีของออกซิเจนตั้งไข่ที่มีอยู่ตรงกลางดังในสมการ ร้อง:
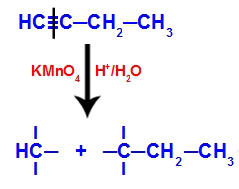
การแตกหักของการเชื่อมต่อแบบ but-1-yne
หลังจากพันธะสามแตก คาร์บอน 1 และ 2 จะได้รับไฮดรอกซิลสามตัว แต่คาร์บอน 1 จะมีอีกอันหนึ่งเพราะ มันมีอะตอมของไฮโดรเจน (ซึ่งจับกับออกซิเจนตั้งไข่) ก่อตัวเป็นโพลิออลสองตัว (ส่วนที่ 1 และ 2)

สมการแทนการก่อตัวของโพลิออล
ไม่นานหลังจากนั้น เนื่องจากโพลิออลไม่เสถียร เราจึงมีการก่อตัวของโมเลกุลของน้ำจากไฮดรอกซิล ในส่วนที่ 1 โมเลกุลของน้ำปรากฏขึ้น (เพราะมีไฮดรอกซิลสามตัว) และในส่วนที่ 2 โมเลกุลสองตัวปรากฏขึ้น (เพราะมีไฮดรอกซิลสี่ตัว)
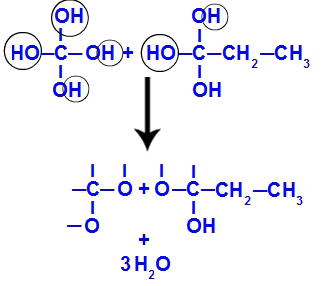
การก่อตัวของโมเลกุลของน้ำจากชิ้นส่วน but-1-yne
สุดท้าย เรามีการก่อตัวของพันธะคู่ระหว่างคาร์บอนที่สูญเสียไฮดรอกซิลและออกซิเจนที่สูญเสียไฮโดรเจนซึ่งก่อให้เกิดคาร์บอนิล

การก่อตัวของคาร์บอนิลในชิ้นส่วน but-1-yne
จากสมการข้างต้น เราจะเห็นได้ว่า but-1-yne ก่อให้เกิดกรดคาร์บอกซิลิกและคาร์บอนไดออกไซด์ (CO .)2).
By Me. ดิโอโก้ โลเปส ดิอาส
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/oxidacao-energetica-alcinos.htm



