ตามที่อธิบายไว้ในข้อความ ปฏิกิริยาเพิ่มเติมปฏิกิริยาอินทรีย์เหล่านี้มักเกิดขึ้นกับสารประกอบที่มีความไม่อิ่มตัว (พันธะคู่หรือ ทริปเปิ้ล) ซึ่งพันธะ pi แตก ทำให้อะตอมหรือกลุ่มของอะตอมเข้าไปในสายโซ่ คาร์บอนิก
อย่างไรก็ตาม ปฏิกิริยาประเภทนี้ยังเกิดขึ้นในกรณีของ ไซโคลอัลเคน (ไฮโดรคาร์บอนสายโซ่ปิดที่มีพันธะอิ่มตัว (ง่าย) ระหว่างคาร์บอนเท่านั้น) ที่มีอะตอมของคาร์บอนสามหรือสี่อะตอม สังเกตตัวอย่างด้านล่าง ซึ่งเป็นโบรมีน (ปฏิกิริยาฮาโลเจน) ของไซโคลโพรเพน:
CH2
/ \ + br2 → br CH2 CH2 CH2 ─ br
โฮ2C CH2
ในทำนองเดียวกัน ยังมีปฏิกิริยาการเติมที่เรียกว่าไฮโดรฮาโลจิเนชันหรือการเติมเฮไลด์ดังที่แสดงด้านล่าง:
CH2
/ \ + HBr → โฮ CH2 CH2 CH2 ─ br
โฮ2C CH2
สังเกตว่า ในทั้งสองกรณี โมเลกุลถูกรบกวนและเกิดสารประกอบสายโซ่เปิดขึ้น
แต่ สิ่งนี้ไม่ได้เกิดขึ้นอย่างง่ายดายในไซโคลอัลเคนที่มีอะตอมของคาร์บอนตั้งแต่ห้าอะตอมขึ้นไป ในทางกลับกัน สารประกอบเหล่านี้มีแนวโน้มที่จะทำงานมากกว่า ปฏิกิริยาการทดแทนซึ่งพันธะไม่แตกสลาย แต่มีไฮโดรเจนอะตอมหนึ่งอะตอมหรือมากกว่าที่ถูกพันธะกับคาร์บอนถูกแทนที่ด้วยอะตอมของธาตุอื่น
ไซโคลเพนเทนยังสามารถทำปฏิกิริยาการเติมได้ แต่ที่อุณหภูมิสูงขึ้นเท่านั้น (ประมาณ 300 องศาเซลเซียส) ในกรณีของไซโคลเฮกเซนนี่เป็นเรื่องยากมาก สิ่งที่ทำได้จริงคือปฏิกิริยาทดแทน เช่น คลอรีนต่อไปนี้:
CH2 CH2
/ \ / \
โฮ2C CH2 โฮ2ซี ซี ─ Cl
│ │ + Cl2→ │ │ + โฮCl
โฮ2C CH2 โฮ2C CH2
\ / \ /
CH2 CH2
วงแหวนที่มีอะตอมของคาร์บอนตั้งแต่ 5 อะตอมขึ้นไปจะไม่ทำปฏิกิริยากับกรดไฮโดรฮาลิก เช่น HBr นอกจากนี้ ปฏิกิริยา
แต่ทำไมสิ่งนี้ถึงเกิดขึ้น? เหตุใดไซโคลอัลเคนสามหรือสี่คาร์บอนจึงทำปฏิกิริยาการเติม และไซโคลอัลเคนที่มีอะตอมของคาร์บอนมากกว่ามักจะไม่ทำ
นั่นเป็นเพราะไซโคลโพรเพนและไซโคลบิวเทนไม่เสถียรมากกว่า ดังนั้นจึงง่ายต่อการทำลายพันธะ
โยฮันน์ ฟรีดริช อดอล์ฟ ฟอน ไบเออร์ (ค.ศ. 1835-1917)
เพื่ออธิบายสิ่งนี้นักเคมีชาวเยอรมัน Johann Friedrich Adolf von Bayer (1835-1917) ได้พัฒนาในปี 1885 สิ่งที่เรียกว่า ทฤษฎีความเค้นแหวน Ringซึ่งแสดงให้เห็นว่า พันธะทั้งสี่ที่เกิดจากอะตอมของคาร์บอนจะมีเสถียรภาพมากขึ้นเมื่อมีมุมเท่ากับ109º 28'เช่นเดียวกับมีเทนดังต่อไปนี้:

พันธะเดี่ยวทั้งสี่ของมีเทนมีมุม 109º 28'
นี่คือมุมที่เสถียรที่สุดเพราะสอดคล้องกับระยะห่างสูงสุดที่เป็นไปได้ระหว่างอะตอมในรูปทรงจัตุรมุข ด้วยเหตุนี้แรงผลักทางอิเล็กทรอนิกส์ (แรงผลักระหว่างอิเล็กตรอนในชั้นเวเลนซ์ของอะตอม) จึงเล็กลง
ไซโคลอัลเคนที่มีคาร์บอนสาม สี่ และห้ามีมุมพันธะระหว่างคาร์บอนน้อยกว่า 109º 28 ' ดู:
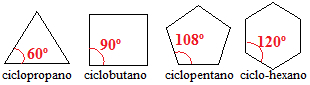
มุมของพันธะไซโคลแอลเคน
ตามมุมจริงเหล่านี้ ซึ่งเราสามารถเรียกโดยทั่วไปว่า α ได้ การคำนวณความเค้นของพันธะสามารถทำได้โดยใช้สูตรต่อไปนี้:
ความตึงเครียด = 109º 28' - α
2
เรารู้ว่าไซโคลโพรเพนเป็นไซโคลอัลเคนที่ไม่เสถียรที่สุดและเป็นไซโคลอัลเคนที่มีปฏิกิริยามากที่สุดด้วย และสิ่งนี้ได้รับการยืนยันโดยการคำนวณแรงดันไฟฟ้าของวงแหวนเมื่อเปรียบเทียบกับตัวอื่นๆ:
แรงดันไซโคลโพรเพน = 109º 28' – 60º = 109º – 60º + 28' = 49º + 28' = 24,5º + 14
2 2 2
เนื่องจาก0.5º = 30 เรามี:
แรงดันไซโคลโพรเพน = 24º + 30' + 14' = 24º 44'
แรงดันไซโคลบิวเทน = 109º 28' – 90º = 9º 44'2
แรงดันไซโคลเพนเทน = 109º 28' – 108º = 0º 44'2
ตามทฤษฎีความตึงเครียดของไบเออร์ ยิ่งความตึงเครียดนี้มากเท่าไร ไซแคลนก็จะยิ่งไม่เสถียรมากขึ้นเท่านั้น กล่าวคือ ความแตกต่างระหว่างมุมจริง (α) กับมุมเชิงทฤษฎี (109º 28') ไม่เสถียรมากกว่า และทำให้มีปฏิกิริยาตอบสนองมากขึ้น สาร
นั่นเป็นสาเหตุที่ไซโคลโพรเพนมีความเสถียรน้อยที่สุดของไซโคลอัลเคน
อย่างไรก็ตาม มีข้อผิดพลาดในทฤษฎีของไบเออร์ เพราะถ้าเราทำการคำนวณความเครียดนี้สำหรับไซโคลเฮกเซน โดยที่มุมเชื่อมต่ออยู่ที่ 120° เราจะเห็นว่าค่านั้นจะเล็กกว่าของไซโคลโพรเพน โดยให้เท่ากับ -5° 16' สิ่งนี้จะชี้ให้เห็นถึงความจริงที่ว่าไซโคลเฮกเซนควรมีความไม่เสถียรมากยิ่งขึ้นและดำเนินการปฏิกิริยาเพิ่มเติม ซึ่งไม่ใช่กรณีในทางปฏิบัติ
คำอธิบายสำหรับข้อเท็จจริงนี้ถูกค้นพบในปี พ.ศ. 2433 โดยนักเคมีชาวเยอรมัน แฮร์มันน์ ซัคเซ และได้รับการพิสูจน์ในปี พ.ศ. 2461 โดยนักเคมีชาวเยอรมัน เอิร์นส์ มอห์ร์ ตามที่นักวิทยาศาสตร์เหล่านี้ ข้อผิดพลาดในทฤษฎีความเค้นวงแหวนของไบเออร์จะอยู่ที่ข้อเท็จจริงที่ว่าเขาพิจารณาว่าไซโคลอัลเคนทั้งหมดเป็นระนาบเดียวกัน นั่นคือ อะตอมของคาร์บอนทั้งหมดอยู่ในระนาบเดียว com ภาพวาดของโครงสร้างที่แสดงด้านบน
อย่างไรก็ตาม ในความเป็นจริง วงแหวนของไซโคลอัลเคนที่มีอะตอมของคาร์บอนมากกว่า 5 อะตอมไม่ได้แบนราบ แต่เป็นอะตอมของพวกมัน ได้รับโครงสร้างเชิงพื้นที่ที่ยกเลิกความตึงเครียดระหว่างการเชื่อมต่อ สร้างมุม109º 28' ระหว่าง การเชื่อมต่อ
ตัวอย่างเช่น ดูกรณีของไซโคลเฮกเซน อันที่จริง มันไม่ได้แบนด้วยมุม 120° ระหว่างพันธะ แต่อันที่จริง อะตอมของมันจะ "หมุนวน" ทำให้เกิดรูปแบบที่เป็นไปได้สองแบบ คือ โครงสร้าง "เก้าอี้" และ "เรือ":
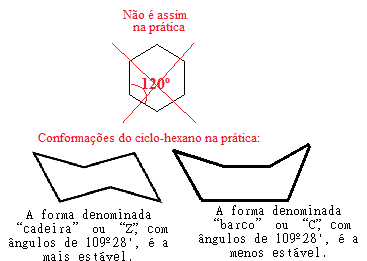
รูปแบบที่เป็นไปได้ของไซโคลเฮกเซนในทางปฏิบัติ
โปรดทราบว่าเนื่องจากมุมจริงของไซโคลเฮกเซนเท่ากับ 109º 28' มันเป็นสารประกอบที่เสถียรมาก ดังนั้นโมเลกุลของไซโคลเฮกเซนจึงไม่แตก จึงไม่มีส่วนร่วมในปฏิกิริยาการเติม นอกจากนี้ โปรดทราบว่ารูปทรงของ "เก้าอี้" จะมั่นคงที่สุด เนื่องจากเป็นรูปทรงที่เด่นกว่าในส่วนผสมเสมอ in เพราะในรูปแบบนี้ อะตอมของไฮโดรเจนที่ถูกผูกมัดกับคาร์บอนนั้นอยู่ห่างจากกันมาก คนอื่น ๆ
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/teoria-das-tensoes-dos-aneis-bayer.htm

