ปฏิกิริยาที่ผันกลับได้มักจะเริ่มต้นด้วยรีเอเจนต์จำนวนหนึ่ง เมื่อปฏิกิริยาโดยตรงเริ่มต้นขึ้น เมื่อเวลาผ่านไป รีเอเจนต์เหล่านี้จะถูกใช้สำหรับการก่อตัว ของผลิตภัณฑ์ ดังนั้นความเข้มข้นของรีเอเจนต์จะลดลงในขณะที่ความเข้มข้นของผลิตภัณฑ์ เพิ่มขึ้น จากนั้นปฏิกิริยาผกผันก็เริ่มสร้างสารตั้งต้นเช่นกัน จนกระทั่งอัตราการพัฒนา (ความเร็ว) ของปฏิกิริยาโดยตรงและปฏิกิริยาผกผันยังคงเหมือนเดิมจนถึงระดับที่เรียกว่า สมดุลเคมี.
ในสภาวะสมดุลมีค่าคงที่สมดุล Kc ซึ่งโดยทั่วไปแสดงโดย:
|
Kc = [ผลิตภัณฑ์]ค่าสัมประสิทธิ์ในสมการเคมีที่สมดุล [รีเอเจนต์]ค่าสัมประสิทธิ์ในสมการเคมีที่สมดุล |
นั่นคือการพิจารณาปฏิกิริยาสมดุลทั่วไปต่อไปนี้:
a A + b B ↔ c C + d D
เนื่องจากตัวพิมพ์เล็กคือสัมประสิทธิ์ และตัวพิมพ์ใหญ่คือสสาร ค่าคงที่สมดุลของปฏิกิริยานี้จะเท่ากับ:
Kc = [ค]ค. [ด]d
[THE]. [B]บี
รายละเอียดเพิ่มเติมสามารถดูได้ในข้อความ ค่าคงที่สมดุล Kc และ Kp. ข้อความนี้ยังแสดงให้เราเห็นสิ่งที่สำคัญ: ค่า Kc สามารถแสดงให้เราเห็นว่าความเข้มข้นของรีเอเจนต์และ ผลิตภัณฑ์มีค่าเท่ากันหรือถ้าตัวใดตัวหนึ่งมีค่ามากกว่าตัวอื่น และด้วยเหตุนี้ หากสมดุลเคมีเคลื่อนไปในทิศทางใดทิศทางหนึ่ง ปฏิกิริยา.
เราจึงต้องหาค่า Kc ในการทำเช่นนี้ โปรดจำไว้ว่าการคำนวณเหล่านี้เป็นการทดลอง ดังนั้นเรามาดูตัวอย่างของปฏิกิริยาและข้อมูลที่ได้รับจากปฏิกิริยาเหล่านี้กัน
สิ่งที่มีประโยชน์มากในการคำนวณเหล่านี้คือการเขียนตารางที่คล้ายกับที่แสดงด้านล่างและทำตามขั้นตอนที่กล่าวถึงในนั้น:

ตารางการจัดระเบียบข้อมูลที่ใช้ในการคำนวณค่าคงที่สมดุล
ตอนนี้ไปฝึกกันเถอะ:
ตัวอย่างที่ 1: ในภาชนะปิดที่มีความจุ 2 ลิตร ที่อุณหภูมิ 100°C จะมี N. 20 โมล2อู๋4. ปฏิกิริยาย้อนกลับต่อไปนี้เริ่มเกิดขึ้น: N2อู๋4 ↔ ไม่2. หลังจากนั้นไม่นาน พบว่าปฏิกิริยาถึงสมดุลเคมีและ NO and 8 โมล2 ได้ก่อตัวขึ้น ค่าคงที่สมดุล Kc ที่อุณหภูมิ 100°C เป็นเท่าใด
ความละเอียด:
ลองใช้ตาราง:

ตารางที่ใช้แก้ ตัวอย่างการคำนวณค่าคงที่สมดุล
โปรดทราบว่าในบรรทัดที่เขียนปริมาณที่ทำปฏิกิริยาและรูปแบบ เรารู้ว่า 4 โมลของ N ถูกใช้ไป2อู๋4เนื่องจากอัตราส่วนคือ 1: 2 และ 8 โมลของ NO ถูกสร้างขึ้น were2.
ตอนนี้เพียงแค่แทนที่ค่าที่พบในการแสดงออกของค่าคงที่สมดุล Kc ของปฏิกิริยานี้:
Kc = [ที่2]2
[น2อู๋4]
Kc = (4 โมล/ลิตร) 2
(8 โมล/ลิตร)
Kc = 2 โมล/ลิตร
ค่า Kc ไม่มีมิติ ไม่มีหน่วยที่เกี่ยวข้องกับขนาดใดๆ
มาดูตัวอย่างกัน ซึ่งมีผลิตภัณฑ์ตั้งแต่เริ่มต้น:
ตัวอย่างที่ 2: ในภาชนะปิดที่มีความจุ 5 ลิตร ที่อุณหภูมิ T มีก๊าซไฮโดรเจน 2 โมล ก๊าซไอโอดีน 3 โมล และไฮโดรเจนไอโอไดด์ 4 โมล ปฏิกิริยาเข้าสู่สมดุลเคมีที่อุณหภูมิ T และปรากฎว่ามีก๊าซไฮโดรเจน 1 โมลในถัง กราฟแสดงสมดุลนี้คืออะไร และค่าคงที่สมดุล Kc ที่อุณหภูมิ T เป็นเท่าใด
ความละเอียด:
ใช้ตาราง:
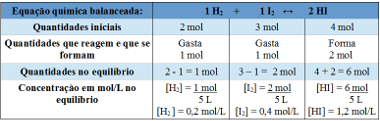
ตารางที่ใช้หาค่าคงที่สมดุล
กราฟที่แสดงความผันแปรของความเข้มข้น mol/L ของรีเอเจนต์และผลิตภัณฑ์จนกว่าจะถึงสมดุลสามารถกำหนดได้โดย:

กราฟสมดุลเคมีแสดงการเปลี่ยนแปลงความเข้มข้นของตัวทำปฏิกิริยาและผลิตภัณฑ์
ตอนนี้เราค้นพบค่าคงที่สมดุล:
Kc =__[สวัสดี]2__
[ห้2 ]. [ผม2]
Kc = (1,2)2
0,2. 0,4
Kc = 18
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm