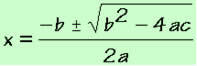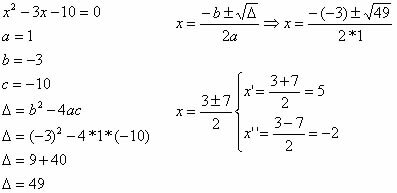พันธะโควาเลนต์เกิดขึ้นเมื่ออะตอมสองอะตอมใช้คู่อิเล็กตรอนร่วมกันเพื่อให้ได้รูปแบบอิเล็กตรอนของ an ก๊าซมีตระกูล (มีอิเล็กตรอน 8 ตัวในเปลือกเวเลนซ์หรือ 2 ตัวในกรณีของอิเล็กตรอนที่มีเพียงเปลือก K) ตามกฎของ ออกเตต
อย่างไรก็ตาม มีกรณีพิเศษของพันธะโควาเลนต์ซึ่ง คู่อิเล็กตรอนที่ใช้ร่วมกันนั้นมาจากอะตอมตัวใดตัวหนึ่งที่เสถียรอยู่แล้ว. ก่อนหน้านี้ พันธะโควาเลนต์ประเภทนี้เรียกว่า dative, วันนี้เรียกกันทั่วไปว่า ประสานงาน.
ดูตัวอย่างเพื่อทำความเข้าใจว่าสิ่งนี้เกิดขึ้นได้อย่างไร:
- CO (คาร์บอนมอนอกไซด์):
คาร์บอนมีอิเล็กตรอน 4 ตัวอยู่ในเปลือกเวเลนซ์ ดังนั้น ตามกฎออกเตต ต้องรับอิเลคตรอนเพิ่มอีก 4 ตัว รวมเป็น 8 ตัว ถึงจะเสถียร ในทางกลับกัน ออกซิเจนมีอิเล็กตรอน 6 ตัวในเปลือกเวเลนซ์และจำเป็นต้องได้รับอิเล็กตรอน 2 ตัวจึงจะได้รับการกำหนดค่าของนีออนก๊าซมีตระกูล
อย่างแรกเลย คาร์บอนและออกซิเจนใช้อิเล็กตรอนร่วมกันสองคู่ เพื่อให้ออกซิเจนมีความเสถียร:
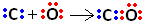
อย่างไรก็ตาม คาร์บอนยังคงไม่เสถียร เนื่องจากยังมีอิเลคตรอน 6 ตัวและต้องการ 2 ตัว ดังนั้นออกซิเจนซึ่งมีความเสถียรอยู่แล้วจึงแบ่งปันอิเล็กตรอนคู่หนึ่งกับคาร์บอนนั่นคือมันสร้างพันธะเดิมกับมันทำให้มีเสถียรภาพ:

โปรดทราบว่าพันธะโควาเลนต์ประสานสามารถแสดงด้วยเส้นประ เช่นเดียวกับพันธะโควาเลนต์ทั่วไป
- เท่านั้น2 (ซัลเฟอร์ไดออกไซด์):
อะตอมของกำมะถันและออกซิเจนแต่ละอะตอมมีอิเล็กตรอน 6 ตัวในเปลือกเวเลนซ์ ดังนั้นพวกมันจึงต้องได้รับอิเล็กตรอน 2 ตัวต่ออิเล็กตรอน ในขั้นต้น กำมะถันสร้างพันธะโควาเลนต์ร่วมกันสองพันธะ โดยใช้อิเล็กตรอนร่วมกันสองคู่กับอะตอมของออกซิเจนตัวใดตัวหนึ่ง ซึ่งทั้งสองมีความเสถียรด้วยอิเล็กตรอน 8 ตัว
แต่อะตอมออกซิเจนอื่นนั้นไม่เสถียร ดังนั้นกำมะถันจึงใช้อิเล็กตรอนร่วมกับมันผ่านพันธะโควาเลนต์ที่มีการประสานกันหรือสืบเนื่อง:
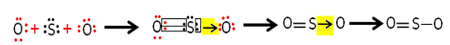
โปรดทราบว่าในกรณีนี้ เรามีสามอะตอมในโมเลกุล จึงสามารถย้ายพันธะจากอะตอมหนึ่งไปยังอีกอะตอมหนึ่งได้ โมเลกุลซัลเฟอร์ไดออกไซด์ยังสามารถแสดงได้ดังนี้: O ─ S ═ O.
เราเรียกปรากฏการณ์ความผูกพันนี้ว่า เสียงสะท้อน. ดูตัวอย่างเพิ่มเติมสามตัวอย่างในตารางด้านล่าง:
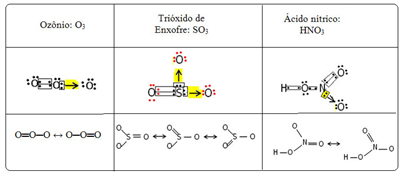
โครงสร้างที่เป็นไปได้เรียกว่า โครงสร้างเรโซแนนซ์ หรือ รูปแบบบัญญัติ.
พันธะประเภทนี้ยังเกิดขึ้นในการก่อตัวของไอออนเช่นในกรณีของไอออนไฮโดรเนียม (H3โอ+) และแอมโมเนียม (NH4+).
ประการแรก H cation+ มันก่อตัวขึ้นเมื่อไฮโดรเจนสูญเสียอิเล็กตรอนเพียงตัวเดียว ปล่อยให้มันมีประจุบวก จึงต้องรับอิเลคตรอน 2 ตัวจึงจะเสถียร สิ่งนี้เกิดขึ้นผ่านพันธะเดทีฟกับน้ำ (ในกรณีของไฮโดรเนียมไอออน) และกับแอมโมเนีย (ในกรณีของแอมโมเนียมไอออน) ดู:

โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm