อ แบบจำลองอะตอมของชโรดิงเงอร์ เป็นแบบฟอร์มทั่วไปที่ใช้ในการกำหนด คำอธิบายของอะตอม โดยการแก้สมการชโรดิงเงอร์ ซึ่งเสนอโดยนักฟิสิกส์ชาวออสเตรีย เออร์วิน ชเรอดิงเงอร์ ในปี พ.ศ. 2470 สมการนี้คิดขึ้นจากการสังเกตที่สำคัญที่ได้รับจากกลศาสตร์ควอนตัม นำมาซึ่งเหตุผลที่ชัดเจนสำหรับพลังงานของอะตอมและอิเล็กตรอน
อะตอมที่ชเรอดิงเงอร์คิดขึ้นมีพื้นฐานอยู่บนความเป็นคู่ของคลื่น-อนุภาค บนหลักการความไม่แน่นอน ท่ามกลางแนวคิดอื่นๆ ที่บัญญัติขึ้นเมื่อต้นศตวรรษที่ 20 มันนำมาซึ่งความก้าวหน้าอย่างมากในการทำความเข้าใจสสาร ในขณะที่มันปูทางไปสู่ความเข้าใจที่มั่นคงยิ่งขึ้นเกี่ยวกับอะตอมโพลีอิเล็กทรอนิกส์ ซึ่งเป็นสิ่งที่ไม่สามารถทำได้กับแบบจำลองอะตอมที่เสนอโดยบอร์
อ่านด้วย: แบบจำลองอะตอม — แบบจำลองที่นำเสนอเพื่ออธิบายโครงสร้างของอะตอม
หัวข้อของบทความนี้
- 1 - สรุปแบบจำลองอะตอมของชโรดิงเงอร์
- 2 - แบบจำลองอะตอมของชเรอดิงเงอร์คืออะไร
-
3 - พื้นฐานการทดลองสำหรับแบบจำลองอะตอมของชโรดิงเงอร์
- ผลตาแมว
- ความเป็นคู่ของอนุภาคคลื่น
- หลักความไม่แน่นอน
- 4 - ลักษณะของแบบจำลองอะตอมของชโรดิงเงอร์
- 5 - ความก้าวหน้าของแบบจำลองอะตอมของชโรดิงเงอร์ซึ่งสัมพันธ์กับแบบจำลองอะตอมอื่นๆ
บทสรุปเกี่ยวกับแบบจำลองอะตอมของชโรดิงเงอร์
แบบจำลองอะตอมของชโรดิงเงอร์แท้จริงแล้วเป็นการอธิบายอะตอมและอิเล็กตรอนผ่านสมการชโรดิงเงอร์
สมการชโรดิงเงอร์ได้รับการพัฒนาผ่านการศึกษาที่สำคัญในด้านกลศาสตร์ควอนตัม
ความเป็นคู่ของคลื่นและอนุภาค หลักการความไม่แน่นอน รวมถึงทฤษฎีอื่นๆ มีความสำคัญต่อการสร้างสมการชโรดิงเงอร์
การแก้สมการชโรดิงเงอร์ ทำให้สามารถอธิบายพลังงานของอะตอมและของอิเล็กตรอนได้
จากการตีความสมการชโรดิงเงอร์ จะเห็นได้ว่าไม่มีอิเล็กตรอน วงโคจรที่แน่นอนรอบอะตอม แต่เป็นบริเวณที่น่าจะมีอยู่รอบๆ จากเขา.
การศึกษาของชโรดิงเงอร์ขยายความ ความเข้าใจเกี่ยวกับอะตอมที่เสนอโดยบอร์เนื่องจากช่วยให้เข้าใจพฤติกรรมของอะตอมโพลีอิเล็กทรอนิกส์
แบบจำลองอะตอมของชโรดิงเงอร์คืออะไร?
แบบจำลองอะตอมของชโรดิงเงอร์เป็นชื่อสามัญของ คำอธิบายแบบจำลองอะตอมตามกลศาสตร์ควอนตัม. ลักษณะสำคัญของแบบจำลองนี้คือการตีความทางคณิตศาสตร์ของความเป็นคู่ของคลื่น-อนุภาคที่รับมาจากอิเล็กตรอน และอื่นๆ โดยเฉพาะการแทนที่วิถีโคจรของอิเล็กตรอนที่กำหนดไว้อย่างดีโดยความน่าจะเป็นของการมีอยู่ของอิเล็กตรอนรอบๆ แกนกลาง
การตีความดังกล่าวเริ่มต้นจากผลงานของนักวิทยาศาสตร์ชาวออสเตรีย Erwin Schrödinger ในปี 1927 หลังจากความก้าวหน้าที่สำคัญ ในการทำความเข้าใจเรื่องกลศาสตร์ควอนตัม เช่น โฟโตอิเล็กทริกเอฟเฟกต์ หลักการความไม่แน่นอน และความเป็นคู่ คลื่นอนุภาค
ความเข้าใจเกี่ยวกับแบบจำลองอะตอมของชเรอดิงเงอร์นั้นไม่ใช่เรื่องเล็กน้อย แต่กำลังได้รับการติดต่อในระดับที่สูงขึ้นของการศึกษาวิชาเคมี
อย่าหยุดตอนนี้... มีเพิ่มเติมหลังจากการประชาสัมพันธ์ ;)
พื้นฐานการทดลองสำหรับแบบจำลองอะตอมของชโรดิงเงอร์
ก่อนการศึกษาของ Erwin Schrödinger มีความก้าวหน้าที่สำคัญใน ความเข้าใจในเรื่อง ในตอนต้นของศตวรรษที่ 20 การทดลองดังกล่าวได้ริเริ่มความรู้ทางทฤษฎีที่เรียกว่ากลศาสตร์ควอนตัม ซึ่งทำให้เกิดการตีความเกี่ยวกับพฤติกรรมของอนุภาคที่ใกล้เคียงหรือต่ำกว่าระดับอะตอม ในเอกภพที่เฉพาะเจาะจงนี้ กฎของฟิสิกส์คลาสสิกหรือที่เรียกว่าฟิสิกส์ของนิวตัน มักจะใช้ไม่ได้หรือไม่เพียงพอที่จะอธิบายพฤติกรรมบางอย่าง
เพื่อให้ได้แนวคิด เราสามารถพูดได้ว่ากลศาสตร์ควอนตัมเริ่มต้นด้วยหัวข้อที่เรียกว่าหายนะรังสีอัลตราไวโอเลต ตามหลักฟิสิกส์คลาสสิก วัตถุสีดำ (วัตถุร้อน) ที่มีอุณหภูมิแตกต่างจากศูนย์จะปล่อยรังสีอัลตราไวโอเลตเข้มข้น นอกเหนือจากรังสีแกมมาและรังสีเอกซ์
ซึ่งหมายความว่ามนุษย์เราซึ่งมีอุณหภูมิ 36-37 °C จะเรืองแสงในที่มืด ไม่จำเป็นต้องพูด นี่เป็นเรื่องไร้สาระโดยสิ้นเชิง เพราะหากเป็นเช่นนั้น จะไม่มีความมืด
ในบริบทนี้, ในปี 1900 Max Planck ได้สร้างแนวคิดของ เท่าไรซึ่งแปลว่า "แพ็คเก็ตพลังงาน" เพื่ออธิบายการแลกเปลี่ยนพลังงานระหว่างสสารและรังสี ตามการตีความของเขา ร่างกายที่อุณหภูมิต่ำ (เช่นเรา) ไม่มีพลังงานเพียงพอที่จะปล่อยรังสีอัลตราไวโอเลตความถี่สูง
ดังนั้น ร่างกายสามารถปล่อยรังสีอัลตราไวโอเลตความถี่สูงได้ก็ต่อเมื่อร่างกายได้รับพลังงานที่จำเป็นน้อยที่สุดเท่านั้น ในสภาวะนี้ การแลกเปลี่ยนพลังงานระหว่างสสารและสภาพแวดล้อมเกิดขึ้นผ่านแพ็กเก็ตของพลังงานรังสี
แพ็กเก็ตพลังงานยังทำให้เกิดความแตกต่างในด้านฟิสิกส์คลาสสิกอีกด้วย เมื่อพูดถึงแพ็คเก็ตของพลังงาน มันหมายถึงพลังงานที่ถูกวัดเป็นปริมาณนั่นคือมีความเฉพาะเจาะจงมีการกำหนดขอบเขต ในฟิสิกส์ของนิวตัน ปริมาณการแลกเปลี่ยนพลังงานระหว่างวัตถุสองชิ้นนั้นไม่มีข้อจำกัด
ผลตาแมว
เพื่อให้ทฤษฎีที่เสนอโดย Planck มีประสิทธิภาพจำเป็นต้องมีหลักฐานเพิ่มเติม ในบริบทนี้ เอฟเฟกต์โฟโตอิเล็กทริกปรากฏขึ้นซึ่งเกี่ยวข้องกับการขับอิเล็กตรอนออกจากโลหะผ่านอุบัติการณ์ของรังสีอัลตราไวโอเลตบนพื้นผิวของมัน
ตามข้อสังเกตของทฤษฎีนี้ จะไม่มีอิเล็กตรอนถูกขับออกมาจนกว่าการแผ่รังสีจะมีความถี่ถึงค่าหนึ่ง ซึ่งจำเพาะสำหรับโลหะแต่ละชนิด เมื่อถึงความถี่นี้ อิเล็กตรอนจะถูกขับออกมาทันที และยิ่งความถี่ของการแผ่รังสีที่ตกกระทบรุนแรงมากขึ้น อิเล็กตรอนที่พุ่งออกมาก็จะยิ่งมีความเร็วมากขึ้นเท่านั้น
ก อัลเบิร์ต ไอน์สไตน์ ให้คำอธิบายเกี่ยวกับโฟโตอิเล็กทริกเอฟเฟกต์. จากข้อมูลของไอน์สไตน์ รังสีแม่เหล็กไฟฟ้า (เช่น แสงคือรังสีแม่เหล็กไฟฟ้า) ที่ใช้สำหรับการดีดอิเล็กตรอน ประกอบด้วย อนุภาคที่เรียกว่าโฟตอนและยิ่งกว่านั้น แต่ละโฟตอนสามารถตีความได้ว่าเป็นแพ็กเก็ตของพลังงาน จากการศึกษาของพลังค์ สรุปได้ว่าโฟตอนของรังสีอัลตราไวโอเลตมีพลังมากกว่าโฟตอนของแสงที่ตามองเห็น

เมื่อชนกับพื้นผิวของโลหะ โฟตอน (องค์ประกอบของรังสีแม่เหล็กไฟฟ้า) จะแลกเปลี่ยนพลังงานกับอิเล็กตรอนที่อยู่ในนั้น ถ้าพลังงานที่อิเล็กตรอนดูดกลืนไว้จากการชนกับโฟตอนมีมากพอ ก็จะถูกขับออกมา หากต้องการเรียนรู้เพิ่มเติมเกี่ยวกับเอฟเฟกต์โฟโตอิเล็กทริก ให้คลิก ที่นี่.
ความเป็นคู่ของอนุภาคคลื่น
โฟโตอิเล็กทริกเอฟเฟ็กต์ทำให้เกิดรากฐานที่แข็งแกร่งว่ารังสีแม่เหล็กไฟฟ้าประกอบด้วยอนุภาค (โฟตอน) อย่างไรก็ตาม การทดลองอื่น ๆ อีกมากมายระบุว่ารังสีแม่เหล็กไฟฟ้าทำตัวเหมือนคลื่น จากการทดลองเหล่านี้ สิ่งที่โดดเด่นที่สุดคือการเลี้ยวเบน ซึ่งเป็นปรากฏการณ์ทางกายภาพที่สังเกตได้เมื่อคลื่นพบกับสิ่งกีดขวาง หรืออีกความหมายหนึ่งก็คือ ความสามารถของคลื่นในการเอาชนะสิ่งกีดขวาง.
อ ลักษณะคลื่นของแสงเป็นที่รู้จักมาตั้งแต่ปี 1801เมื่อโทมัส ยัง นักฟิสิกส์ชาวอังกฤษฉายแสงบนสิ่งกีดขวางที่มีรอยกรีด เมื่อผ่านช่องนี้ แสงจะเกิดการเลี้ยวเบน ที่ช่องแคบแต่ละช่อง ซึ่งรวมถึงแสงที่ส่องผ่าน แม้จะมีการเลี้ยวเบน แสงก็จะเกิดการเลี้ยวเบนใหม่

แบบนี้, จำเป็นต้องยอมรับพฤติกรรมใหม่สำหรับการแผ่รังสีแม่เหล็กไฟฟ้า: ความเป็นคู่ของคลื่น-อนุภาค จากนั้นนักวิทยาศาสตร์ชาวฝรั่งเศส Louis de Broglie ได้ขยายแนวคิดนี้ โดยเสนอว่าควรเข้าใจอนุภาคทั้งหมดว่ามีพฤติกรรมเป็นคลื่น
สมมติฐานของ de Broglie ได้รับความเข้มแข็งในปี 1925 เมื่อนักวิทยาศาสตร์ชาวอเมริกัน Clinton Davisson และ Lester Germer พิสูจน์ว่าลำแสงอิเล็กตรอนสามารถเกิดการเลี้ยวเบนเมื่อผ่านผลึกเดี่ยวของ นิกเกิล.
การรับรู้นี้จำเป็นต่อการได้ข้อสรุปว่าอนุภาคที่หนักกว่า เช่น โมเลกุล สามารถเกิดการเลี้ยวเบนได้เช่นกัน ดังนั้นจึงแสดงพฤติกรรมคล้ายคลื่น หากต้องการเรียนรู้เพิ่มเติมเกี่ยวกับความเป็นคู่ของอนุภาคคลื่น ให้คลิก ที่นี่.
หลักความไม่แน่นอน
ในฟิสิกส์คลาสสิก เป็นเรื่องง่ายสำหรับคุณที่จะกำหนดวิถีโคจรของอนุภาค อย่างไรก็ตาม ในโลกควอนตัมซึ่งอนุภาคมีพฤติกรรมเหมือนคลื่น วิถีการเคลื่อนที่ของพวกมันไม่แม่นยำอีกต่อไป ทั้งนี้เพราะ มันไม่สมเหตุสมผลเลยที่จะพูดถึงตำแหน่งของคลื่น.
ตัวอย่างเช่น บนกีตาร์ เมื่อคุณดีดสาย คลื่นจะกระจายออกไปตลอดความยาวของสาย หากอนุภาคมีพฤติกรรมแบบเดียวกันนี้ จะไม่มีทางระบุตำแหน่งของมันได้อย่างแม่นยำแม้แต่น้อย รู้โมเมนตัมเชิงเส้นของมัน (ปริมาณที่ผสมมวลและความเร็ว).
ดังนั้น อิเล็กตรอนซึ่งมีลักษณะเป็นคู่จึงไม่มีวงโคจร/เส้นทางรอบนิวเคลียสของอะตอมตามที่หลายคนเชื่อ กจากนั้นความเป็นคู่จะสร้างความไม่แน่นอนเกี่ยวกับตำแหน่งที่แน่นอนของอนุภาค
ความไม่แน่นอนในคำจำกัดความของตำแหน่งนี้มีความสำคัญเล็กน้อยสำหรับวัตถุที่หนักมาก แต่มีความสำคัญอย่างเต็มที่สำหรับวัตถุที่มีขนาดอะตอมหรือ subatomic กล่าวคือ ถ้าคุณรู้ว่าอนุภาคนั้นอยู่ในที่ใดที่หนึ่ง ณ ช่วงเวลาหนึ่ง คุณจะไม่รู้อีกต่อไปว่าอนุภาคนั้นจะไปอยู่ที่ไหนในอนาคต ทันที.
จากภาวะที่กลืนไม่เข้าคายไม่ออกนี้ทำให้เกิดหลักการความไม่แน่นอนก่อตั้งโดยนักฟิสิกส์ชาวเยอรมัน แวร์เนอร์ ไฮเซนเบิร์ก ในปี พ.ศ. 2470 ตามหลักการนี้ เป็นไปไม่ได้ที่จะทราบตำแหน่งและโมเมนตัมเชิงเส้นของอนุภาคโดยไม่มีค่าความคลาดเคลื่อน กล่าวคือ หากทราบคุณสมบัติหนึ่ง คุณสมบัติอื่นจะไม่ทราบ หากต้องการเรียนรู้เพิ่มเติมเกี่ยวกับหลักความไม่แน่นอน คลิก ที่นี่.
คุณลักษณะของแบบจำลองอะตอมของชโรดิงเงอร์
จากลักษณะคู่ของอนุภาคทำให้ไม่สามารถกำหนดวิถีโคจรเฉพาะของมันได้อีกต่อไป ในปี พ.ศ. 2470 เออร์วิน นักวิทยาศาสตร์ชาวออสเตรีย ชเรอดิงเงอร์แทนที่วิถีโคจรที่แม่นยำด้วยฟังก์ชันคลื่น, เขียนแทนด้วยอักษรกรีก psi (ψ) โดยค่าของฟังก์ชันนี้จะแตกต่างกันไปตามตำแหน่ง ตัวอย่างของฟังก์ชันคลื่นคือฟังก์ชันไซน์ของ x.
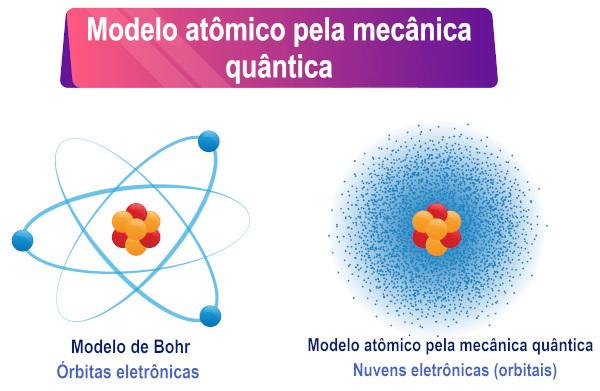
จากนั้นนักวิทยาศาสตร์ Max Born ได้สร้างการตีความทางกายภาพสำหรับฟังก์ชันคลื่น โดยระบุว่า กำลังสองของฟังก์ชัน ψ นั่นคือ ψ² จะเป็นสัดส่วนกับความน่าจะเป็นที่จะพบอนุภาคใน ภูมิภาค. ดังนั้นจึงเข้าใจว่า ψ² เป็นความหนาแน่นของความน่าจะเป็นในการค้นหาอนุภาคในบางพื้นที่ เนื่องจากเป็นความหนาแน่นของความน่าจะเป็น ค่าของ ψ² จะต้องคูณด้วยปริมาตรเพื่อให้ได้ค่าความน่าจะเป็นที่แท้จริง
ในการคำนวณฟังก์ชันคลื่น ชเรอดิงเงอร์ได้พัฒนาสมการ, ง่ายดังนี้:
Hψ = Eψ
Hψ ควรอ่านเป็น “แฮมิลตันของ psi” และอธิบายความโค้งของฟังก์ชันคลื่น Hamiltonian เป็นตัวดำเนินการทางคณิตศาสตร์ เช่นเดียวกับเครื่องหมายบวก ลบ บันทึก ฯลฯ ด้านขวานำพลังงานที่สอดคล้องมาให้เรา
การแก้สมการนี้ทำให้เราได้ข้อสรุปที่สำคัญ: อนุภาคสามารถมีพลังงานที่ไม่ต่อเนื่องเท่านั้นนั่นคือ พลังงานที่กำหนดมาอย่างดี หรือเชิงปริมาณ และไม่มีค่าใดๆ ค่าพลังงานเฉพาะเหล่านี้เรียกว่าระดับพลังงาน นี่เป็นการกำหนดฟังก์ชันคลื่น เนื่องจากต้องพอดีกับพื้นที่เฉพาะ ในกลศาสตร์คลาสสิก วัตถุสามารถมีค่าเท่าใดก็ได้ของพลังงานทั้งหมด
แบบนี้, อิเล็กตรอนไม่สามารถมีพลังงานใดๆแต่ระดับพลังงานที่กำหนดไว้อย่างดี เนื่องจากฟังก์ชันคลื่นจำเป็นต้องพอดีกับพื้นที่หนึ่งๆ โปรดจำไว้ว่า อิเล็กตรอนถูกจำกัดอยู่ภายในอะตอม ผ่านแรงดึงดูดที่มีต่อนิวเคลียส
ระดับพลังงานของอะตอมสามารถคำนวณได้โดยการแก้สมการชโรดิงเงอร์อย่างเหมาะสม ในกรณีนี้ จะสังเกตเห็นว่าความละเอียดไปถึงสมการใหม่ ซึ่งแสดงให้เห็นว่าพลังงานของแต่ละระดับในอะตอมขึ้นอยู่กับจำนวนเต็ม ซึ่งเรียกว่า นซึ่งยืนยันแนวคิดที่ว่าระดับพลังงานมีค่าเฉพาะ
ดังนั้นการกำหนดค่าบวกให้กับ น (1, 2, 3...) สามารถคำนวณพลังงานของระดับอะตอมได้ พารามิเตอร์ น ปัจจุบันเรียกว่าเลขควอนตัมหลัก เนื่องจากสุดท้ายจะเชื่อมโยงกับแต่ละระดับอะตอมที่อนุญาตสำหรับอะตอม
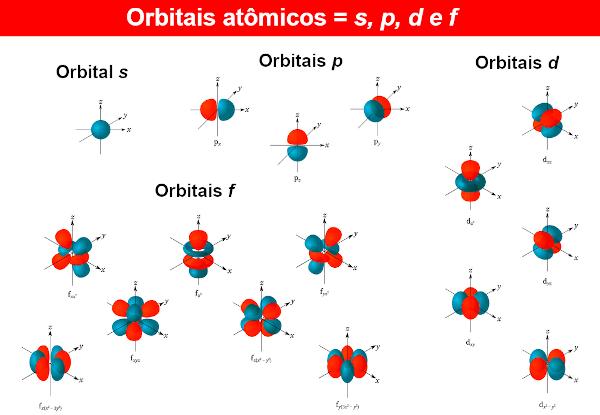
ถึง ฟังก์ชันคลื่นอิเล็กตรอนเรียกว่าออร์บิทัลของอะตอมซึ่งนิพจน์ทางคณิตศาสตร์ได้มาจากการแก้สมการชโรดิงเงอร์ ออร์บิทัลของอะตอมแสดงการกระจายตัวของอิเล็กตรอนในอะตอม นั่นคือ พื้นที่ของความน่าจะเป็นของการมีอยู่ของอิเล็กตรอนในอะตอม ออร์บิทัลของอะตอมสามารถมีรูปร่างและพลังงานต่างกัน ซึ่งได้จากสมการชโรดิงเงอร์เช่นกัน
สำหรับทุกระดับพลังงาน น (จำได้ว่า. น เป็น 1, 2, 3...) ก็มี น ระดับย่อย. ในแต่ละระดับย่อยมีวงโคจรที่มีรูปร่างต่างกัน ไม่มีการจำกัดวงโคจรที่แตกต่างกัน แต่ด้วยอะตอมที่รู้จักจนถึงตอนนี้ นักเคมีใช้เพียงสี่อะตอมเท่านั้น โดยระบุด้วยตัวอักษร ส, พี, ง มันคือ ฉ.
ตัวอย่างเช่นในระดับ น = 1 มีระดับย่อยเพียงระดับเดียว ดังนั้นจึงมีเพียงออร์บิทัลเท่านั้น ส. ตอนนี้สำหรับระดับ น = 2 มีสองระดับย่อย คือวงโคจรที่มีอยู่ ส มันคือ พี.
ความก้าวหน้าของแบบจำลองอะตอมของชโรดิงเงอร์ที่สัมพันธ์กับแบบจำลองอะตอมอื่นๆ
ดังที่กล่าวไว้ ชเรอดิงเงอร์ไม่จำเป็นต้องนำเสนอแบบจำลอง แต่เป็นการตีความทางคณิตศาสตร์ สำหรับปรากฏการณ์ที่สังเกตได้เกี่ยวกับธรรมชาติของอนุภาค ดังนั้นการตีความจึงซับซ้อน เนื่องจากสมการชโรดิงเงอร์เองต้องการความรู้ทางคณิตศาสตร์ขั้นสูงเพื่อความละเอียดและแม้แต่การตีความ
อย่างไรก็ตาม การศึกษาของชเรอดิงเงอร์นำมาซึ่งความแข็งแกร่งอย่างมากในการปรับพลังงานของอะตอมและอิเล็กตรอน ของขวัญ ตัวอย่างเช่น ความละเอียดของสมการชโรดิงเงอร์ยืนยันแบบจำลองอะตอมของบอร์สำหรับอะตอมไฮโดรเจนและอะตอมของไฮโดรเจนอื่นๆ (ที่มีอิเล็กตรอนเพียง 1 ตัว) เช่นเดียวกับชโรดิงเงอร์ บอร์มาถึงระดับพลังงานที่อนุญาตสำหรับอะตอมไฮโดรเจน
อย่างไรก็ตาม แบบจำลองอะตอมของบอร์ไม่สามารถเข้าถึงระดับอิเล็กทรอนิกส์สำหรับอะตอมที่มีอิเล็กตรอนมากกว่า 1 ตัว ดังนั้นจึงแสดงให้เห็นถึงจุดอ่อนหลักของมัน เมื่อมีอิเล็กตรอนสองตัว จำเป็นต้องพิจารณาการผลักกันทางอิเล็กทรอนิกส์ระหว่างอิเล็กตรอนสองตัว ซึ่งเป็นพารามิเตอร์ที่สามารถเพิ่มเข้าไปในความเข้าใจทางคณิตศาสตร์ที่เสนอโดยชเรอดิงเงอร์
ประเด็นสำคัญอีกประการหนึ่งของการศึกษาของชโรดิงเงอร์คือการปรับแนวคิดควอนตัม เช่น ความเป็นสองเท่าของอนุภาค เช่นเดียวกับวิถีโคจรที่แน่นอนของอิเล็กตรอน คำจำกัดความของวงโคจรของอะตอมมีความสำคัญมากต่อการทำความเข้าใจ โครงสร้างของอะตอมทั้งหมด. ก ความหนาแน่นของความน่าจะเป็น (ψ²) ช่วยให้เราเข้าใจว่าอิเล็กตรอนครอบครองออร์บิทัลของอะตอมได้อย่างไร ในอะตอมของโพลีอิเล็คทรอนิกส์ ทำให้ได้ข้อมูลที่เฉพาะเจาะจงมากขึ้นเกี่ยวกับพลังงานของอิเล็กตรอน
โดย Stefano Araujo Novais
ครูสอนเคมี
เรียนรู้เพิ่มเติมเกี่ยวกับโครงสร้างของอะตอมและอนุภาคที่เป็นส่วนประกอบหลัก: โปรตอน นิวตรอน และอิเล็กตรอน
รู้จักวิวัฒนาการของแบบจำลองอะตอมในประวัติศาสตร์
คลิกและเรียนรู้เกี่ยวกับคุณสมบัติหลักของแบบจำลองอะตอมของรัทเทอร์ฟอร์ดและการทดลองที่ทำให้เกิดการผสมสูตร
ค้นหาว่าอะไรคือลักษณะสำคัญ ปัญหา และการเสนอแบบจำลองอะตอมของทอมสันจากแง่มุมใด!
เข้าไปและพบกับอะตอมของบอร์ ซึ่งเป็นแบบจำลองอะตอมตามสมมุติฐานที่อธิบายอะตอมไฮโดรเจนได้สำเร็จ