นักวิทยาศาสตร์ชื่อ ฟรีดริช โคห์ลเราช์ (ค.ศ. 1840-1910) เป็นคนแรกที่เสนอว่าน้ำบริสุทธิ์นำไฟฟ้าได้ แม้ว่าจะมีขนาดเล็ก เนื่องจากน้ำมีพฤติกรรมในลักษณะแอมโฟเทอริก นั่นคือ บางครั้งก็ทำหน้าที่เหมือนกรด ให้โปรตอน (H+); และบางตัวก็มีลักษณะเหมือนฐานรับโปรตอน
ซึ่งหมายความว่าน้ำจะทำการแตกตัวเป็นไอออนของมันเอง ตามสมการทางเคมีที่แสดงด้านล่าง:
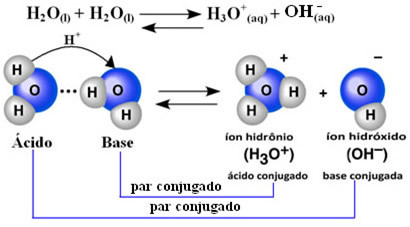
กระบวนการนี้เรียกว่า การทำให้เป็นน้ำอัตโนมัติ และเกิดขึ้นในระดับที่เล็กมาก กล่าวคือ น้ำเป็นอิเล็กโทรไลต์ที่อ่อนแอมาก โดยมีค่าระดับการแตกตัวเป็นไอออนต่ำและค่าคงที่การแตกตัวเป็นไอออนที่สมดุล (Kค). นี่คือสาเหตุที่น้ำมีค่าการนำไฟฟ้าต่ำเช่นนี้
เพื่อให้ได้แนวคิด ที่อุณหภูมิแวดล้อม 25°C เป็นไปได้ที่จะระบุความเข้มข้นของไฮดรอกไซด์และไฮโดรเนียมไอออนที่เกิดขึ้นในการแตกตัวเป็นไอออนในตัวเองของน้ำบริสุทธิ์เท่ากับ 1 10-7 โมล หลี่-1. ซึ่งหมายความว่าจากหนึ่งพันล้านโมเลกุลของน้ำ มีเพียงสองไอออไนซ์
ค่าคงที่สมดุลไอออนิกของน้ำเรียกว่า คค่าคงที่การแยกตัวของน้ำautoprotolysis คงที่หรือ ผลิตภัณฑ์ไอออนิกของน้ำ.ค่าคงที่นี้แสดงโดย Kwเพราะ w หมายถึงคำว่า น้ำซึ่งในภาษาอังกฤษหมายถึงน้ำ
การคำนวณจะทำในลักษณะเดียวกับค่าคงที่สมดุลอื่น ๆ โดยจำได้ว่าตามที่ระบุไว้ในข้อความ "ค่าคงที่ของ สมดุล Kc และ Kp” ในกรณีนี้ เฉพาะผลิตภัณฑ์เท่านั้นที่จะปรากฏในนิพจน์ เพราะน้ำในสถานะของเหลวมีกิจกรรมเหมือนกัน ถึง 1 สารของเหลวหรือของแข็งบริสุทธิ์จะไม่ถูกใส่ลงในนิพจน์คงที่การแยกตัวเนื่องจากไม่เปลี่ยนแปลง วางเฉพาะสารละลายที่เป็นน้ำและก๊าซเท่านั้น ดังนั้นเราจึงมี:
Kw = [H3อู๋+]. [โอ้-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
เช่นเดียวกับค่าคงที่สมดุลอื่นๆ ตกลงw มันเปลี่ยนไปตามการเปลี่ยนแปลงของอุณหภูมิเท่านั้น เมื่ออุณหภูมิของน้ำเพิ่มขึ้น ไอออไนเซชันก็เพิ่มขึ้นด้วย ซึ่งหมายความว่าการทำให้ไอออไนซ์ในตัวเองของน้ำเป็นกระบวนการดูดความร้อน กล่าวคือ มันดูดซับความร้อน
ดังจะเห็นได้จากค่าของผลิตภัณฑ์ไอออนิกของน้ำ (Kw) แสดงไว้ในตารางด้านล่างที่อุณหภูมิต่างกัน:
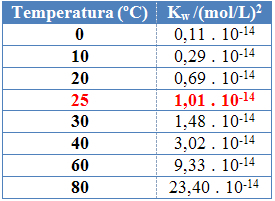
ผลิตภัณฑ์ไอออนิกของน้ำจะมีค่าคงที่ในแต่ละอุณหภูมิเสมอ ไม่ว่าจะในน้ำบริสุทธิ์หรือในสารละลาย แม้ว่าสารละลายจะมีความเข้มข้นของไอออน H3อู๋+ และโอ้- ต่างกัน ผลคูณระหว่างกันจะคงที่
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm



