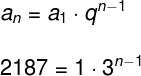เธ นิโฮเนียม, เลขอะตอม 113 และสัญลักษณ์ Nh เป็นองค์ประกอบทางเคมีที่อยู่ในกลุ่มที่ 13 ของตารางธาตุ นอกจากนี้ยังเป็นองค์ประกอบที่มีน้ำหนักมากซึ่งไม่พบในธรรมชาติ ดังนั้นการได้มาซึ่งสามารถทำได้โดยเทียมผ่านปฏิกิริยานิวเคลียร์ฟิวชัน ลักษณะทางเคมีของไนโฮเนียมยังไม่ชัดเจนนัก แต่สันนิษฐานว่าอาจมีพฤติกรรมคล้ายกับแทลเลียมที่มีน้ำหนักเบากว่าในบางกรณี
นิโฮเนียมได้มาจากการหลอมครั้งแรก 70Zn กับ 209Bi ที่สถาบัน Riken ประเทศญี่ปุ่น ในปี พ.ศ. 2546 แม้ว่านักวิทยาศาสตร์ชาวรัสเซียและชาวอเมริกันจะขอให้เป็นที่รู้จักในฐานะผู้ค้นพบองค์ประกอบ 113 แต่ IUPAC ก็ยอมรับนักวิทยาศาสตร์ชาวญี่ปุ่น ชื่อนี้หมายถึงคำว่า Nihon เนื่องจากชาวญี่ปุ่นเรียกประเทศบ้านเกิดของตน
อ่านด้วย: แกลเลียม — องค์ประกอบทางเคมีอื่นที่อยู่ในกลุ่มที่ 13 ของตารางธาตุ
สรุปเกี่ยวกับนิโฮเนียม
เป็นองค์ประกอบทางเคมีสังเคราะห์ที่อยู่ในกลุ่มที่ 13 ของ ตารางธาตุ.
การผลิตเริ่มขึ้นในปี 2546 ที่สถาบัน Riken ประเทศญี่ปุ่น
ประกอบด้วยกลุ่มขององค์ประกอบล่าสุดที่รวมอยู่ในตารางธาตุในปี 2015
การศึกษาของเขายังเพิ่งเกิดขึ้นไม่นาน แต่บางคนพยายามที่จะเชื่อมโยงกับองค์ประกอบอื่นๆ ของกลุ่ม 13 เช่นแทลเลียม
การผลิตคือ นิวเคลียร์ฟิวชั่น, โดยใช้ไอโซโทปของ 70Zn และอะตอมของ 209บี.
คุณสมบัติของ Nihonium
สัญลักษณ์: ไม่นะ
เลขอะตอม: 113
มวลอะตอม: ระหว่าง 278 ถึง 286 c.u. (ไม่เป็นทางการโดย Iupac)
การกำหนดค่าทางอิเล็กทรอนิกส์: [Rn] 7s2 5f14 6 วัน10 7p1
ไอโซโทปที่เสถียรที่สุด:286Nh (9.5 วินาทีของ ครึ่งชีวิตซึ่งสามารถเพิ่มขึ้น 6.3 วินาที หรือลดลง 2.7 วินาที)
ชุดเคมี: กลุ่มที่ 13 ธาตุหนักสุด
ลักษณะของนิโฮเนียม
Nihonium สัญลักษณ์ Nh และเลขอะตอม 113 เป็นหนึ่งในองค์ประกอบสุดท้ายที่รวมอยู่ในตารางธาตุ. เป็นทางการเมื่อวันที่ 30 ธันวาคม 2015 โดย International Union of Pure and Applied Chemistry (IUPAC) ในขณะที่ชื่อนี้ได้รับการประกาศอย่างเป็นทางการในช่วงกลางปี 2016
ธาตุในบริเวณนี้ของตารางธาตุมีความไม่เสถียรสูง หมายความว่าไม่สามารถพบได้ในธรรมชาติ ดังนั้น เมื่อเผชิญกับการมีอยู่ที่ถูกกล่าวหา พวกมันจะได้รับการสลายตัวของกัมมันตภาพรังสีแทบจะในทันที ซึ่งเป็นการปล่อยอนุภาคนิวเคลียร์ เช่น α และ β เพื่อให้ได้ความเสถียรที่มากขึ้น
อย่างไรก็ตาม เมื่อพวกมันปล่อยอนุภาคนิวเคลียร์ พวกมันจะถูกแปลงสภาพด้วยนิวเคลียร์ นั่นคือ พวกมันกลายเป็นองค์ประกอบทางเคมีใหม่ ดังนั้น ธาตุหนักยิ่งยวด เช่น Nh ต้องถูกผลิตขึ้นในห้องปฏิบัติการ ซึ่งทำให้เป็น องค์ประกอบทางเคมีสังเคราะห์.
Nh เช่นเดียวกับองค์ประกอบ superheavy อื่น ๆ ได้รับอิทธิพลจาก ผลสัมพัทธภาพ — อย่างง่าย คือ ระยะทางจากสิ่งที่สังเกตถึงสิ่งที่คาดไว้ เนื่องจากสัมพัทธภาพ ดังนั้นการศึกษาทางคณิตศาสตร์ในสาขาทฤษฎีซึ่งจำลองผลสัมพัทธภาพได้ชี้ให้เห็นว่าไนโฮเนียม สามารถโต้ตอบกับควอตซ์ได้เล็กน้อย แต่ เพื่อที่จะมี ดูดซับได้ดีถึง ทองเช่นเดียวกับแทลเลียม (Tl) ที่มีน้ำหนักเบากว่า
การศึกษาเชิงทฤษฎีเบื้องต้นยังระบุด้วยว่า ความผันผวน จาก น. สำหรับการดูดซับควอทซ์ แทลเลียมสามารถสร้าง TlOH ได้ทันที และคาดว่าไนฮอเนียมจะทำเช่นเดียวกัน
ยังไงก็ได้ การศึกษายังคงเป็นเบื้องต้นและล่าสุดสิ่งที่ผลิตขึ้นส่วนใหญ่เปิดให้อภิปราย และเป็นการยากที่จะกำหนดคุณสมบัติทางเคมีฟิสิกส์ของนิฮอเนียมได้อย่างถูกต้อง
การได้รับ Nihonium
ธาตุ 113 จวบจนวันนี้ ได้มาในสองวิธี: ผ่าน ปฏิกิริยาฟิวชันเย็นด้วยการหลอมรวมของสังกะสี (Zn, Z = 30) กับบิสมัท (Bi, Z = 83) และยังผ่าน การสลายตัวของอัลฟาของธาตุ 115.
ในตัวอย่างแรก สังกะสี เร่งเป็น 10% ของ ความเร็วของแสงเพื่อที่จะเอาชนะแรงผลักของนิวเคลียสทั้งสอง จากนั้นจึงผลิตไอโซโทป 279Nh ซึ่งจบลงด้วยการปล่อยนิวตรอนและผลิต 278น.

ด้วยครึ่งชีวิตประมาณ 34 มิลลิวินาที ไอโซโทป 278Nh ผ่านการสลายตัวของอัลฟ่าหกครั้ง (การปล่อยอนุภาคแอลฟา) ไปยังธาตุเมนเดเลเวียม (Md)
ในกรณีที่สอง องค์ประกอบ 113 เกิดขึ้นจากการสลายตัวของอัลฟาของธาตุ 115 (ปัจจุบันรู้จักกันในชื่อ muscovium) หลังจากที่มันถูกสังเคราะห์ วิธีหนึ่งคือปฏิกิริยาฟิวชั่นร้อนของไอออน 48Ca กับไอโซโทป 243อ่า กำลังผลิต 288Mc และจากนั้น โดยการสลายตัวของอัลฟา, the 284Nh ซึ่งยังคงได้รับการสลายตัวของอัลฟา
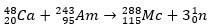
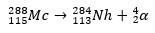
ดูด้วย: แฮสเซียม — องค์ประกอบทางเคมีสังเคราะห์ที่หนักที่สุดที่มีการวิเคราะห์คุณสมบัติของมัน
ประวัติของนิโฮเนียม
การค้นหาองค์ประกอบ 113 เริ่มขึ้นในปี 2546 นักวิจัยชาวญี่ปุ่นที่สถาบัน Riken เร่งไอโซโทปของ 70Zn ที่ความเร็ว 10% ของความเร็วแสงเพื่อชนกับ 209Bi ผ่านปฏิกิริยาฟิวชัน ดังนั้นพวกเขาจึงสามารถผลิตสิ่งที่เรารู้ในขณะนี้เป็น 278น.
อย่างไรก็ตาม มันเป็นเพียงในปี 2012 ที่ นักวิจัยชาวญี่ปุ่นสามารถตรวจพบชุดการสลายตัวของอัลฟาที่สมบูรณ์ได้ ขององค์ประกอบ 113 ติดต่อ IUPAC เพื่ออ้างสิทธิ์การค้นพบ
นักวิทยาศาสตร์ชาวรัสเซียนำโดย Yuri Oganessian ร่วมกับ. ร่วมกับความพยายามของญี่ปุ่น นักวิทยาศาสตร์ชาวอเมริกันยังได้ระบุองค์ประกอบ 113 ผ่านการสลายอัลฟาของธาตุด้วย 115. การทดลองดังกล่าวยังทำให้นักวิทยาศาสตร์ชาวรัสเซียและชาวอเมริกันโต้แย้งในการรับรู้องค์ประกอบ 113

อย่างไรก็ตาม IUPAC พบว่าหลักฐานจากสถาบัน Riken นั้นแข็งแกร่งกว่า ดังนั้นจึงอนุญาตให้ชาวญี่ปุ่นมีสิทธิตั้งชื่อองค์ประกอบ 113 ชื่อที่เลือกคือ nihônio สัญลักษณ์ Nh ในการอ้างอิงถึงประเทศ ญี่ปุ่น. คำว่า Japan นั้นเขียนโดยชาวญี่ปุ่นโดยใช้อักษรจีนสองตัวที่แปลว่า "ดินแดนอาทิตย์อุทัย" และอ่านว่า Nihon หรือ Nippon
ชื่อนิโฮเนียมก็ถูกเลือกเช่นกันเพราะในปี 1908 นักเคมีชาวญี่ปุ่น Masataka Ogawa ได้ตีพิมพ์ว่า ได้ค้นพบธาตุ 43 ตั้งชื่อเป็นภาษาญี่ปุ่น สัญลักษณ์ Np (ซึ่งปัจจุบันเป็นของเนปทูเนียม Z = 93). อย่างไรก็ตาม ภายหลังได้พิสูจน์แล้วว่าธาตุ 43 ไม่เสถียร ไม่พบในธรรมชาติ และสังเคราะห์ขึ้นเฉพาะในปี พ.ศ. 2480 ได้ชื่อว่า เทคโนโลยี (ทีซี).
ดังนั้นชาวญี่ปุ่นจึงหายไปจากตารางธาตุ อย่างไรก็ตาม หลายปีต่อมา ก็ได้รับการพิสูจน์แล้วว่า อันที่จริง Ogawa ได้ค้นพบธาตุ 75 (ปัจจุบันรู้จักกันในชื่อ รีเนียม). อย่างไรก็ตาม เมื่อถึงเวลานั้น ธาตุรีเนียมก็ถูกค้นพบอย่างเป็นทางการแล้วในปี 1925 และทำพิธีล้างบาป
แก้ไขแบบฝึกหัดเกี่ยวกับ nihonium
คำถามที่ 1
Nihonium สัญลักษณ์ Nh และเลขอะตอม 113 เป็นองค์ประกอบทางเคมีที่ไม่สามารถพบได้ในธรรมชาติเนื่องจากมีครึ่งชีวิตสั้น ที่คงทนที่สุดของพวกเขา 286Nh มีประมาณ 9.5 วินาที โดยรู้ว่าครึ่งชีวิตเป็นเวลาที่จำนวนของสปีชีส์จะลดลงครึ่งหนึ่ง ปริมาณไอโซโทปด้านบนจะเท่ากับ 1/16 ของปริมาณนั้นใช้เวลากี่วินาที อักษรย่อ?
ก) 9.5
ข) 19
ค) 28.5
ง) 38
จ) 47.5
ปณิธาน:
ทางเลือก D
ทุกๆ 9.5 วินาที ปริมาณไอโซโทปจะลดลงครึ่งหนึ่ง ดังนั้น หลังจาก 9.5 วินาที จำนวนเงินจะเท่ากับครึ่งหนึ่งของจำนวนเงินเริ่มต้น อีก 9.5 วินาที รวมเป็น 19 วินาที จำนวนลดลงครึ่งหนึ่งอีกครั้ง ซึ่งเท่ากับ 1/4 ของค่าเริ่มต้น
ที่ 28.5 วินาที หลังจากผ่านไปครึ่งชีวิตอีกครั้ง ปริมาณจะลดลงครึ่งหนึ่งอีกครั้ง โดยเหลือ 1/8 ของจำนวนเงินเริ่มต้น สุดท้าย หลังจาก 38 วินาที จำนวนเงินจะลดลงครึ่งหนึ่งอีกครั้ง โดยแตะ 1/16 ของจำนวนเงินเริ่มต้น ตามที่ร้องขอในใบแจ้งยอด ดังนั้น เวลาที่ต้องการคือ 38 วินาที
คำถาม2
ในปี 2546 การค้นหาองค์ประกอบ 113 เริ่มขึ้นที่สถาบัน Riken ในญี่ปุ่น ในขณะนั้นนักวิทยาศาสตร์สามารถผลิต 278ผ่านการหลอมรวมของอะตอมสังกะสีและบิสมัท
มีกี่นิวตรอนในไอโซโทปที่ยกมา?
ก) 113
ข) 278
ค) 391
ง) 170
จ) 165
ปณิธาน:
ทางเลือก E
จำนวน นิวตรอน สามารถคำนวณได้ดังนี้
A = Z + n
โดยที่ A คือจำนวน พาสต้า อะตอม, Z คือเลขอะตอมและ n คือจำนวนนิวตรอน แทนค่า เราได้:
278 = 113 + n
n = 278 - 113
n = 165
โดย Stefano Araújo Novais
ครูสอนเคมี